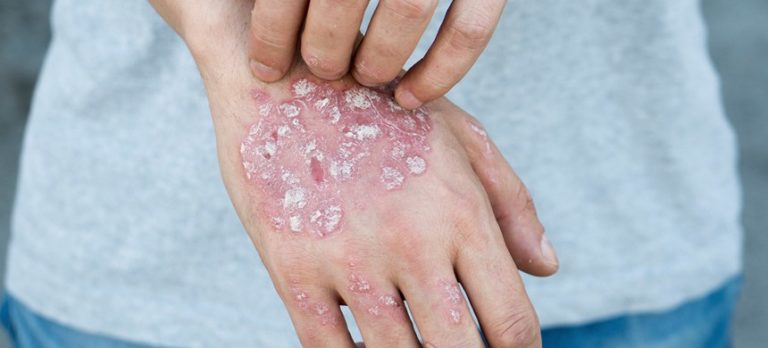
..Redacción.
La Comisión Europea ha aprobado un nuevo anticuerpo monoclonal humanizado de alta afinidad para tratar la psoriasis crónica en adultos. Se trata de tildrakizumab, principio activo bajo la marca Ilumetri y comercializado por la compañía Almirall. De esta forma, se mejora el tratamiento de pacientes adultos con psoriasis crónica en placas de moderada grave que son candidatos a terapia sistémica. Alemania será el primer país en lanzar el producto aunque en las próximas semanas se espera que se introduzca en toda Europa.
Gracias a su mecanismo de acción específico, bloquea de forma selectiva la IL-23 y actúa modificando la patogénesis de la enfermedad con un impacto limitado en el resto del sistema inmune
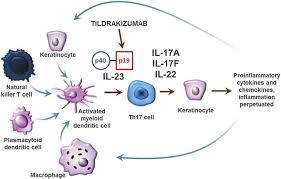 Tildrakizumab es un anticuerpo monoclonal humanizado de alta afinidad anti IL-23p19. Gracias a su mecanismo de acción específico, bloquea de forma selectiva la interleucina-23 (IL-23), un mediador inflamatorio, y actúa modificando la patogénesis de la enfermedad con un impacto limitado en el resto del sistema inmune. Su aprobación supone un paso muy significativo en el tratamiento de esta enfermedad que afecta a unos 125 millones de personas en todo el mundo. En España, la incidencia es del 2,3% y aproximadamente el 20% de estas personas tiene psoriasis de moderada a grave. Se trata de un medicamento con un alto nivel de seguridad y eficacia que consigue un control a largo plazo de la enfermedad.
Tildrakizumab es un anticuerpo monoclonal humanizado de alta afinidad anti IL-23p19. Gracias a su mecanismo de acción específico, bloquea de forma selectiva la interleucina-23 (IL-23), un mediador inflamatorio, y actúa modificando la patogénesis de la enfermedad con un impacto limitado en el resto del sistema inmune. Su aprobación supone un paso muy significativo en el tratamiento de esta enfermedad que afecta a unos 125 millones de personas en todo el mundo. En España, la incidencia es del 2,3% y aproximadamente el 20% de estas personas tiene psoriasis de moderada a grave. Se trata de un medicamento con un alto nivel de seguridad y eficacia que consigue un control a largo plazo de la enfermedad.
Su baja frecuencia de inyecciones podría favorecer también la adherencia al tratamiento, ya que se administra mediante una inyección subcutánea cada tres meses durante el periodo de mantenimiento.
Su baja frecuencia de inyecciones podría favorecer también la adherencia al tratamiento
Resultados positivos de reSURFACE 1 y 2
La Comisión Europea se ha basado para su aprobación en los resultados positivos de los ensayos clínicos reSURFACE 1 y 2, que fueron presentados en 2016 durante el 25º Congreso de la Sociedad Europea de Dermatología y Venereología. Se trata de dos estudios pivotales de fase III que incluyeron a más de 1.800 pacientes de más de 200 centros clínicos de todo el mundo. Los resultados señalan que el 63% de los pacientes lograron un 75% de blanqueamiento de la piel (respuesta de PASI 75) en la semana 12 y una media del 78% a la semana 28, sólo tras tres dosis. Al cabo de un año, más del 92% de los pacientes que habían respondido a tildrakizumab, dentro de las 28 semanas, mantuvieron una respuesta de PASI 75.
 CEO de Almirall: “Supone un hito muy importante para Almirall en el área médica de la dermatología, específicamente en el mercado de los medicamentos biológicos”
CEO de Almirall: “Supone un hito muy importante para Almirall en el área médica de la dermatología, específicamente en el mercado de los medicamentos biológicos”
Por otro lado, más del 50% de los pacientes informaron que la psoriasis ya no afectaba a sus vidas tras sólo 3 dosis. Por lo que este principio activo obtuvo una buena tolerancia con muy pocos efectos adversos graves asociados al tratamiento y una baja tasa de interrupción.
Peter Guenter, CEO de Almirall, sostiene que “constituye una nueva opción terapéutica en Europa para los profesionales de la salud y para los pacientes con psoriasis crónica en placas, de moderada a grave. Tildrakizumab es un inhibidor de la IL-23p19 seguro y fácil de administrar que ofrece una eficacia duradera y una seguridad a largo plazo, y que supone un hito muy importante para Almirall en el área médica de la dermatología, específicamente en el mercado de los medicamentos biológicos”.
Artículos relacionados
- El 85% de los pacientes con psoriasis tienen alguna enfermedad asociada a la misma
- Nace UNiMiD, una asociación que reúne a las mayores organizaciones de pacientes de enfermedades crónicas inflamatorias inmunomediadas
- Guselkumab recibe dos evaluaciones positivas frente a la psoriasis por parte de agencias de tecnología sanitaria europeas