..Redacción.
Han conseguido analizar por primera vez la función de la proteína CTCF in vivo, y han comprobado que su función es esencial para la correcta regulación de los genes responsables del desarrollo embrionario. Es el trabajo de investigadores del Centro Andaluz de Biología del Desarrollo (CABD) de Sevilla que ha publicado la revista Nature Communications y que han destacado líderes de su campo en la revista Nature Structural and Molecular Biology.
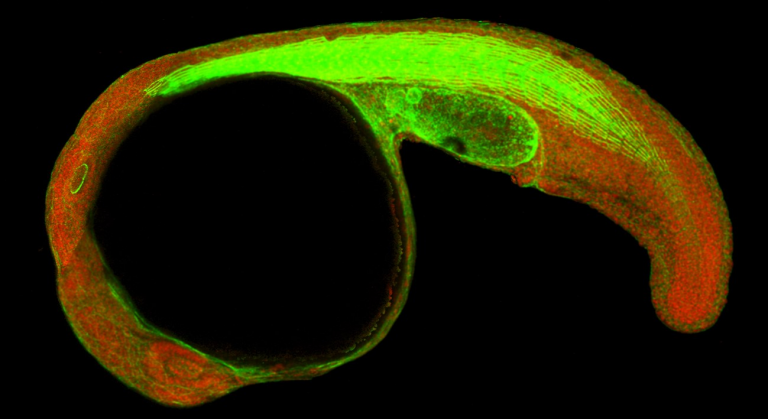
El análisis in vivo de la proteína CTCF se ha llevado a cabo durante el desarrollo embrionario de un pez cebra. Han podido ver su función en fase de formación de órganos y del patrón corporal
El análisis in vivo se ha llevado a cabo durante el desarrollo embrionario de un pez cebra en su fase de formación de órganos y del patrón corporal. El CSIC señala que este análisis abre nuevas vías de estudio. Esta especie animal ha servido como modelo para dilucidar el papel que juega la estructura tridimensional del genoma en la regulación de la expresión de los genes durante el desarrollo embrionario.
Interruptores que apagan y encienden genes
Así, el Dr. José María Santos Pereira, investigador del CABD, un centro mixto del CSIC, la Junta de Andalucía y la Universidad Pablo de Olavide de Sevilla, explica que “aproximadamente el 98% del genoma humano es ADN no codificante, es decir, no contiene genes. Pero, al contrario de lo que se pensó originalmente, gran parte de este ADN no codificante tiene una función”.
“Una parte del ADN no codificante está ocupado por lo que llamamos elementos reguladores que funcionan como interruptores que apagan o encienden a los genes”
“Una parte del ADN no codificante está ocupado por lo que llamamos elementos reguladores, que son secuencias de ADN que, tomando prestada la metáfora que solía usar José Luis [en referencia a José Luis Gómez Skarmeta, investigador del CABD fallecido hace un año y líder del laboratorio donde se ha llevado a cabo este trabajo], funcionan como interruptores que apagan o encienden a los genes”, continúa el investigador.
“Esto ocurre así en todos los vertebrados, como el pez cebra, que comparte aproximadamente un 70% de genes con el ser humano”, destaca. Así, durante el desarrollo embrionario es cuando la regulación de la expresión de los genes alcanza su mayor complejidad. Y esto ocurre así gracias a que los genes responsables del desarrollo están controlados por múltiples de estos interruptores que los encienden y apagan en distintas células y momentos del desarrollo.
La proteína CTCF “se une al ADN y actúa a modo de barrera delimitando las zonas dentro de las cuales pueden actuar los interruptores” sobre los genes durante el desarrollo embrionario
¿Y qué hace la proteína CTCF?
El Dr. Santos Pereira explica que en los últimos años se ha demostrado que el genoma se pliega tridimensionalmente, “como una madeja de lana”. Esto permite el contacto de los interruptores con los genes a los que regula. Y en mamíferos se ha demostrado que una proteína llamada CTCF es clave para el plegamiento 3D del genoma. Pero su función durante el desarrollo embrionario no se había podido estudiar hasta ahora. “Nosotros hemos sido capaces de superar esta limitación utilizando el pez cebra como modelo”, concluye Santos Pereira.
¿Cómo lo hace? La proteína CTCF “se une al ADN y actúa a modo de barrera delimitando las zonas dentro de las cuales pueden actuar los interruptores. En otras palabras, es como si dividiéramos la madeja de lana en una serie de ovillos consecutivos, separados unos de otros. Esto favorece que los interruptores enciendan o apaguen a sus genes diana y evita que enciendan o apaguen a otros que no les corresponde”, apunta el científico.
“Nuestro modelo podría permitirnos averiguar cuál es el impacto de la pérdida de CTCF en los distintos tipos celulares y órganos presentes en el embrión”
De esta forma, los investigadores del grupo de Gómez Skarmeta han visto que, cuando CTCF no está, la ausencia de estas barreras elimina los pequeños ovillos. Así, debilita el contacto de los interruptores con sus genes diana. Al mismo tiempo que se forman nuevos contactos con otros genes, traspasando los límites que normalmente establece CTCF. Esto provoca que se desregulen genes muy importantes en el desarrollo, dando lugar a miles de genes con expresión incorrecta.
La generación de este mutante de CTCF en pez cebra mediante la tecnología CRISPR de edición génica ha aportado un nuevo modelo con el que profundizar en la función de CTCF in vivo, durante el desarrollo embrionario animal, en futuros estudios. “Por ejemplo, la utilización de tecnologías de célula única en nuestro modelo podría permitirnos averiguar cuál es el impacto de la pérdida de CTCF en los distintos tipos celulares y órganos presentes en el embrión, es decir, si su función es más importante en unos tipos celulares que en otros y por qué”, señala Santos Pereira.
También refuerza la idea de que el pez cebra es un modelo ideal para estudiar la pérdida de función de genes humanos que conduce a patologías congénitas.
Noticias complementarias:
- El CSIC identifica un gen cuya alteración afecta al aprendizaje y la memoria que podría ser una nueva diana farmacológica
- El CSIC publica en abierto dos Libros Blancos con los desafíos científicos de la década sobre evolución y genómica
- Describen las señales que sitúan el corazón en el lado izquierdo durante el desarrollo embrionario