..Redacción.
Un equipo de investigadores españoles ha logrado abrir nuevas perspectivas para la terapia celular de enfermedades metabólicas ligadas al cromosoma X. En concreto, investigadores del Instituto de Investigación Sanitaria La Fe (IIS La Fe) y la Universidad de Valencia (UV) liderados por el Dr. Roque Bort, han conseguido generar hepatocitos “sanos” a partir de una paciente con deficiencia de ornitina transcarbamilasa (OTCD), enfermedad hepática ligada al cromosoma X. El trabajo se acaba de publicar en la revista Scientific Reports, de Nature.
Para ello, seleccionaron células no hepáticas que espontáneamente silenciaron el cromosoma X defectuoso para posteriormente diferenciarlas a hepatocitos. La estrategia podría aplicarse a otras enfermedades metabólicas ligadas al cromosoma X, no requiriendo manipulación del genoma de las células para corregir el error genético. Además, se generarían células que, al provenir del propio paciente, serían inmunológicamente compatibles.
 La posibilidad de utilizar estos hepatocitos, derivados de células “sanas”, en trasplante celular ofrecería una alternativa al trasplante de órgano entero
La posibilidad de utilizar estos hepatocitos, derivados de células “sanas”, en trasplante celular ofrecería una alternativa al trasplante de órgano entero
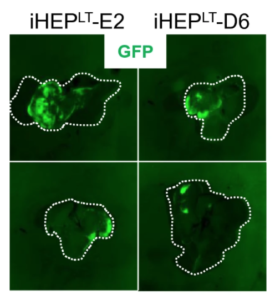
Por otro lado, la posibilidad de utilizar estos hepatocitos, derivados de células “sanas”, en trasplante celular ofrecería una alternativa al trasplante de órgano entero. Algo que no siempre es aplicable, sobre todo a edades tempranas del paciente. Esta prueba de concepto la han realizado en ratones desde la Unidad Mixta IIS La Fe-UV de Investigación en Hepatología Experimental y Trasplante Hepático; integrada en el área de Enfermedades Hepáticas y Digestivas del Ciber (Ciberehd).
Reprogramación directa de los fibroblastos
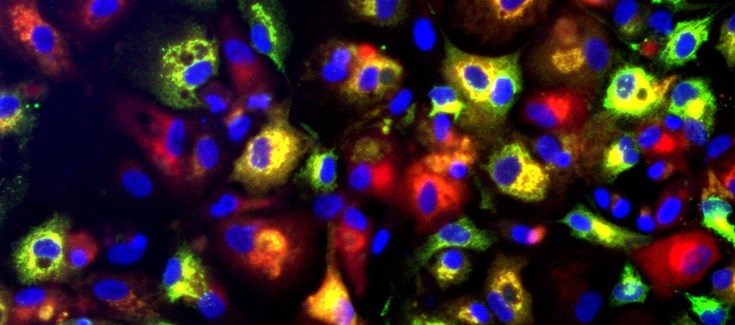
En concreto, el equipo logró separar fibroblastos dérmicos de una paciente heterocigota OTCD y que aleatoriamente expresan uno u otro cromosoma X, seleccionando aquellos que expresan el cromosoma no defectuoso. Después, se realizó una trans-diferenciación a células muy similares a los hepatocitos adultos mediante reprogramación directa de los fibroblastos. El siguiente paso fue el trasplante de las células “sanas” y diferenciadas a ratones. Estas lograron colonizar el hígado y comportarse tal y como lo harían hepatocitos sanos.
Una vez decidido el fenómeno de inactivación de uno u otro alelo del cromosoma X, el inactivado permanece en silencio durante el resto de la vida de esa célula y de sus células hijas o diferenciadas
Según explican los autores, una vez decidido el fenómeno de inactivación de uno u otro alelo del cromosoma X, el inactivado permanece en silencio durante el resto de la vida de esa célula y de sus células hijas o diferenciadas. Así, “las células provenientes de los fibroblastos seleccionados que expresaban el cromosoma X no defectuoso, posteriormente diferenciadas a hepatocitos, eran capaces de desarrollar las funciones metabólicas del ciclo de la urea. Y también de colonizar el hígado y expresar sus funciones cuando fueron trasplantadas a ratones”, señaló el Dr. Ramón Santamaría, primer firmante del trabajo.
 En comparación con las estrategias de terapia génica basadas en actuar sobre el genoma substituyendo o reparando el gen defectuoso, este nuevo procedimiento resulta más eficiente. El motivo es que las estrategias de terapia génica implican una mayor dificultad y riesgo genéticos. Sin embargo, esta alternativa es de aplicación general y presenta menos riesgo que la ingeniería genética. Además, al provenir del mismo paciente las probabilidades de rechazo inmunológico se minimizan.
En comparación con las estrategias de terapia génica basadas en actuar sobre el genoma substituyendo o reparando el gen defectuoso, este nuevo procedimiento resulta más eficiente. El motivo es que las estrategias de terapia génica implican una mayor dificultad y riesgo genéticos. Sin embargo, esta alternativa es de aplicación general y presenta menos riesgo que la ingeniería genética. Además, al provenir del mismo paciente las probabilidades de rechazo inmunológico se minimizan.
Dr. Vicente Castell: “Si se expresa el cromosoma que está íntegro, ese hígado funcionará correctamente y no habrá signos clínicos de la enfermedad”
La inactivación del cromosoma X
De los dos cromosomas X que toda mujer posee, solo uno de ellos permanece activo. Además, los alelos del cromosoma X se expresan aleatoriamente en los distintos tejidos o porciones de él, en un fenómeno que se denomina mosaicismo. La inactivación de uno u otro cromosoma X es un fenómeno epigenético aleatorio que conlleva el silenciamiento transcripcional de uno de los cromosomas X.
De manera que, cuando una mujer es portadora de una enfermedad genética ligada al cromosoma X, y solo uno de ellos está afectado, dependiendo de cuál de los dos cromosomas esté activo en el hígado (el íntegro o el afectado) se manifestará o no la enfermedad.
“Si el cromosoma mayoritariamente expresado en el hígado es el que está dañado, entonces se manifestará el déficit metabólico característico de la enfermedad. Pero si se expresa el que está íntegro, ese hígado funcionará correctamente y no habrá signos clínicos de la enfermedad”, señala el Dr. José Vicente Castell, director de la Unidad Mixta IIS La Fe-Universidad de Valencia de Investigación en Hepatología Experimental y Trasplante Hepático y jefe de grupo del Ciberehd.
Noticias complementarias
- La diabetes gestacional aumenta la predisposición a desarrollar enfermedades metabólicas durante la vida adulta
- Los hepatólogos plantean investigar si pacientes con Covid-19 y enfermedades hepáticas sufren más daños en el hígado
- La teleasistencia una herramienta clave para el tratamiento de los pacientes con enfermedades hepáticas durante la pandemia