Redacción
Alcon presenta Hydrus Microstent, un dispositivo para cirugía de glaucoma mínimamente invasiva

Alcon presentará durante el 100º Congreso de la Sociedad Española de Oftalmología (SEO) su dispositivo para cirugía de glaucoma. Hydrus Microstent está indicado para la reducción de la presión intraocular (PIO) en pacientes con glaucoma primario de ángulo abierto (POAG por sus siglas en inglés), como tratamiento único o junto con una intervención quirúrgica por cataratas.
El mecanismo de acción TriModal incluye la dilatación y refuerzo con precisión del canal de Schlemm, ampliando suavemente el área de la sección transversal sin obstruir el flujo de salida a los ostium del canal colector. Además, abarca aproximadamente 90° del canal de Schlemm, proporcionando acceso a los canales colectores del sistema nasal inferior.
Por otro lado, el Microstent Hydrus puentea la malla trabecular para ayudar a restablecer el flujo del humor acuoso desde la cámara anterior a través de la entrada del Microstent hasta el canal de Schlemm. Hydrus Microstent es el primer implante MIGS (Minimally Invasive Glaucoma Surgery) que ha reportado resultados clínicos a cinco años en un estudio pivotal. Además, se ha demostrado, a través de estudios clínicos globales, que reduce la presión ocular. En la mayoría de los pacientes, esto se tradujo en una reducción del uso de medicamentos para el glaucoma o eliminó la necesidad de medicación.
La Comisión Europea aprueba odevixibat para el tratamiento del prurito colestásico en el síndrome de Alagille, una enfermedad hepática rara
La Comisión Europea ha concedido la autorización de comercialización en circunstancias excepcionales de odevixibat (Kayfanda) para el tratamiento del prurito colestásico en pacientes con síndrome de Alagille (SALG) a partir de seis meses de edad. Odevixibat es un inhibidor del transportador ileal de ácidos biliares (IBAT, por sus siglas en inglés) no sistémico, que se administra una vez al día.
“Los pacientes que sufren el SALG a menudo tienen una calidad de vida muy pobre debido a un picor insoportable, que es uno de los síntomas más importantes de esta enfermedad”, afirmó Christelle Huguet, vicepresidenta ejecutiva y directora de Investigación y Desarrollo de Ipsen. La aprobación de este nuevo fármaco se ha basado en los datos del ensayo clínico de fase III Assert. Assert es el primer y único ensayo de fase III del mundo completado con pacientes que padecen el SALG.
Los resultados del ensayo demostraron mejoras estadística y clínicamente significativas del prurito (intensidad del rascado) desde el inicio hasta el sexto mes, en los pacientes que recibieron odevixibat frente a los que recibieron placebo. Estas mejoras se observaron rápidamente y se mantuvieron durante el período de estudio. También se demostró una reducción estadísticamente significativa en la concentración de ácidos biliares (AB) séricos al final del tratamiento en los pacientes que recibieron la nueva molécula en comparación con los que recibieron placebo, con mejoras en múltiples parámetros del sueño
Almirall presenta nuevos datos sobre biológicos para psoriasis y dermatitis atópica
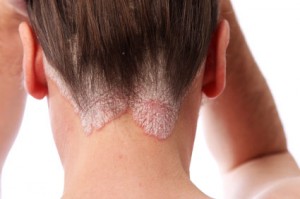
En el marco del 33º Congreso de la Academia Europea de Dermatología y Venereología (EADV), Almirall presentará 34 abstracts en los que se detallarán las últimas investigaciones sobre lebrikizumab, indicado para la dermatitis atópica moderada a grave, tildrakizumab y la crema CAL/BDP de Almirall para la psoriasis en placas moderada a grave, así como tirbanibulina para la queratosis actínica. La compañía también organizará dos simposios, proporcionando de esta manera una plataforma para el intercambio de conocimiento por parte de los profesionales, en la que los expertos podrán debatir y compartir conocimientos acerca de los datos actuales O estudios disponibles, compartan ideas y debatan sobre el tratamiento de estas
Entre esas novedades están los nuevos datos del estudio Positive sobre el tratamiento de adultos con psoriasis en placas moderada a grave con tidrakizumab a las 52 semanas. Es el primer ensayo clínico en dermatología que utiliza el Índice de Bienestar de la WHO5 como criterio de valoración principal. Los diferentes subanálisis que se presentarán durante el congreso refuerzan la eficacia de este biológico sobre los signos y síntomas tanto físicos como psicológicos.
Almirall también presentará nuevos datos sobre lebrikizumab, un biológico aprobado para el tratamiento de la dermatitis atópica de moderada a grave. La presentación Late breaking destacará la eficacia sostenida de este tratamiento durante tres años, junto con nuevos datos sobre las tasas de criterios de valoración absolutos y su eficacia en pacientes inadecuadamente controlados o no elegibles para ciclosporina.
Merck presenta nuevos datos de cladribina comprimidos tras cuatro años que destacan los beneficios del tratamiento precoz y la eficacia sostenida

Merck anuncia datos que muestran el perfil de seguridad a largo plazo, los datos de eficacia sostenida y el efecto duradero de cladribina comprimidos (Mavenclad) en pacientes con esclerosis múltiple recurrente (EMR) en el marco del 40º Congreso del Comité Europeo para el Tratamiento e Investigación de la Esclerosis Múltiple (ECTRIMS).
“La eficacia de cladribina comprimidos ha quedado demostrada por los criterios de valoración principales de nuestros ensayos pivotales y posteriores. Actualmente, con medidas adicionales sobre el impacto de la neuroinflamación y la progresión, podemos reafirmar y consolidar aún más su eficacia a largo plazo en el tratamiento de la EM”, afirma Alexander Kulla, vicepresidente senior y jefe del Departamento Médico de Neurología e Inmunología de Merck. “Este tratamiento sigue demostrando su consistente perfil de seguridad con beneficios sostenidos, impactando en las vidas de más de 100.000 personas que conviven con EM”.
Kern Pharma lanza Condroitín sulfato 400 mg en cápsulas para el tratamiento de la artrosis
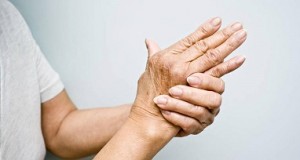
Kern Pharma lanza Condroitín sulfato 400 mg en cápsulas duras EFG para el tratamiento sintomático de la artrosis, una enfermedad articular degenerativa que se caracteriza por la destrucción del cartílago hialino que recubre las superficies óseas y se localiza principalmente en la columna vertical (cervical y lumbar), cadera, rodilla y algunas articulaciones del comienzo del dedo gordo del pie, produciendo dolor, deformidad articular e inflamación entre otros síntomas.
Condroitín sulfato es uno de los principales elementos constitutivos del cartílago, que se une a una proteína central, constituyendo el llamado proteoglicano, que confiere al cartílago sus propiedades mecánicas y elásticas y está indicado en el tratamiento sintomático de la artrosis.
La dosis recomendada de Condroitín sulfato Kern Pharma es de 800 mg al día, por lo que se tomarán dos cápsulas al día, preferiblemente en una sola toma durante al menos tres meses. Condroitín sulfato 400 mg se presenta en cápsulas duras EFG, con 60 unidades por caja. Este producto está sujeto a receta médica y financiado por el Sistema Nacional de Salud. Con este nuevo lanzamiento, Kern Pharma sigue reforzando su vademécum centrado en el alivio del dolor crónico y aportando nuevas soluciones para mejorar la vida de los pacientes.











