..Redacción.
Un equipo de científicos del Centro Nacional de Investigaciones Oncológicas (CNIO) ha descubierto un mecanismo que explica por qué las mutaciones del gen C9ORF72, implicado en casi la mitad de los casos de esclerosis lateral amiotrófica (ELA) familiar, mata a las neuronas motoras. El mecanismo hallado relaciona las mutaciones de este gen con un problema general que bloquea todos los ácidos nucleicos, el ADN y el ARN, e impide así multitud de procesos fundamentales en el funcionamiento de las células.
El equipo del CNIO explica por qué las mutaciones del gen C9ORF72, implicado en casi la mitad de los casos de ELA familiar, mata a las neuronas motoras
El trabajo del Grupo de Inestabilidad Genómica liderado por el bioquímico Óscar Fernández-Capetillo en el CNIO se publica esta semana en The EMBO Journal. La investigación del CNIO abre una puerta al conocimiento de los mecanismos implicados en el desarrollo de la ELA familiar, que supone el 10% de todos los afectados de esclerosis lateral amiotrófica. La ELA familiar tiene un importante componente genético, que hace que aparezca en varios miembros de una familia.
Los investigadores de ELA ya habían observado que, en efecto, en las neuronas de los afectados fallan muchos procesos celulares básicos que utilizan ácidos nucleicos; ahora el grupo del CNIO provee un modelo que los conecta a todos y explica así estos problemas tan generalizados. Aunque el nuevo mecanismo tóxico identificado está asociado a mutaciones en un gen concreto, el C9ORF72, presente en muchos casos de ELA familiar, el grupo del CNIO cree probable que otras mutaciones relacionadas con ELA estén actuando de manera similar, es decir, bloqueando el ADN y ARN de las neuronas motoras.
La ELA familiar supone el 10% de los casos de esclerosis lateral amiotrófica
¿Cómo surgió la idea de investigar en esta línea? Pues tras un café entre Fernández-Capetillo y el premio Nobel Jack Szostak en el CNIO hace siete años. “Szostak investiga la química del origen de la vida, y me contó que para frenar las reacciones con ácidos nucleicos en sus experimentos usaban precisamente péptidos sintéticos con muchas argininas, por su gran afinidad por ellos”, cuenta Fernández-Capetillo. “Entonces pensé, ¿y si es esto lo que está pasando? ¿Y si las proteínas ricas en arginina de los pacientes de ELA están bloqueando de manera general el ADN y el ARN?”.
Este bioquímico, investigador en cáncer, comenzó a trabajar en 2014 en ELA. Estaba convencido de que una técnica que recientemente habían implementado en su grupo podría ayudar a comprender la toxicidad de las mutaciones en el gen C9ORF72. El café con Szostak le puso en la pista de la arginina. Siete años después cree que “tenemos un modelo bastante satisfactorio que nos ayuda a entender que está pasando en las neuronas motoras de los pacientes de ELA, qué las está matando”, explica.
“Szostak me contó que para frenar las reacciones con ácidos nucleicos en sus experimentos usaba péptidos sintéticos con muchas argininas. Pensé, ¿Y si las proteínas ricas en arginina de los pacientes de ELA están bloqueando el ADN y el ARN?”
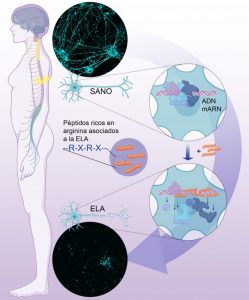
Los investigadores del CNIO explican que las mutaciones en el gen C9ORF72 son tóxicas porque inducen a la célula a producir unas pequeñas proteínas o péptidos muy ricas en arginina. Este aminoácido, por su carga positiva y naturaleza química, se une con mucha avidez a los ácidos nucleicos, el ADN o el ARN. Al pegarse a los ácidos nucleicos con tanta afinidad, estas proteínas desplazan de manera generalizada a todas las proteínas celulares que normalmente interaccionan con el ADN y el ARN. Así, impiden cualquier reacción celular que use ADN o ARN. De esta forma, con sus ácidos nucleicos de facto bloqueados, la célula muere.
En palabras de Fernández-Capetillo, “lo que hemos visto es que los péptidos con arginina son como una especie de alquitrán que se adhiere a los ácidos nucleicos decorándolos. Al hacerlo desplazan a las proteínas que normalmente están unidas a ellos, de manera que no funciona nada tenga que ver con DNA o con RNA”.
“Hemos visto que los péptidos con arginina son como una especie de alquitrán que se adhiere a los ácidos nucleicos. Así desplazan a las proteínas que están unidas a ellos, de manera que no funciona nada tenga que ver con DNA o RNA”
Esa hipótesis inicial se vio refrendada cuando el grupo decidió explorar si estos problemas se observaban también cuando la célula expresase alguna proteína normal que tuviese muchas argininas. Hay una proteína así, pero se expresa únicamente y de manera transitoria durante la generación de espermatozoides. Se trata de la protamina. Su función biológica es desplazar a las histonas del ADN, las proteínas que normalmente ayudan a la compactación del ADN. “Gracias a intercambiar histonas por protamina, que es más pequeña, el ADN de los espermatozoides puede compactarse más”, explica Fernández-Capetillo.
Sin embargo, la protamina es tóxica para cualquier célula que no sea un espermatozoide. “Pensamos que lo que pasa en los pacientes de ELA es equivalente a lo que les pasaría si, accidentalmente, sus neuronas motoras comenzasen a producir protamina”. Así, en el trabajo de The EMBO Journal demuestran que los efectos celulares de la protamina son idénticos a los de los péptidos ricos en arginina encontrados en los pacientes de ELA.
Una vez comprendido por qué son tóxicos los péptidos ricos en arginina, el paso siguiente es buscar cómo combatirla. Y la investigación en esa línea ya ha comenzado en el grupo. También han iniciado el trabajo para crear modelos animales en los que se reproduzca el problema, con el fin de testar potenciales terapias.
Los autores del trabajo creen que el mecanismo generalizado de bloqueo de los ácidos nucleicos es, probablemente, lo que sucede en la ELA en general
Aprender a aliviar la toxicidad de estos péptidos puede ser útil también para abordar los casos de ELA no asociados a C9ORF72, es decir, la enfermedad en su conjunto. Los autores del trabajo creen que el mecanismo generalizado de bloqueo de los ácidos nucleicos es, probablemente, lo que sucede en la ELA, en general.
Como explica Vanesa Lafarga, primera firmante del trabajo junto a Oleksandra Sirozh, “la gran mayoría de las mutaciones halladas en pacientes de ELA son en proteínas que se unen a ARN. Generalmente lo que hacen estas mutaciones es impedir la unión de estas proteínas al ARN. Además, las células de estos pacientes también tienen problemas muy generales con sus ácidos nucleicos”.
Por eso, el equipo cree que, aunque las mutaciones en C9ORF72 afectan a solo una parte de los pacientes de ELA, “el mecanismo subyacente a la toxicidad de las neuronas puede que no sea muy diferente, en lo fundamental, a lo que pasa en el resto de los casos de esta enfermedad. En tratar de demostrar si esto es así es algo en lo que estamos trabajando ahora”, añade Lafarga.












