Redacción
Investigadores del Consejo Superior de Investigaciones Científicas (CSIC) han descubierto un mecanismo proteico relacionado con el desarrollo de la esclerosis lateral amiotrófica (ELA) y la demencia frontotemporal, entre otras patologías neurodegenerativas. Desde el CSIC aseguran que los resultados del estudio, publicados en Nature Communications, podrían ayudar en el diagnóstico médico de estas enfermedades, de cara al futuro.
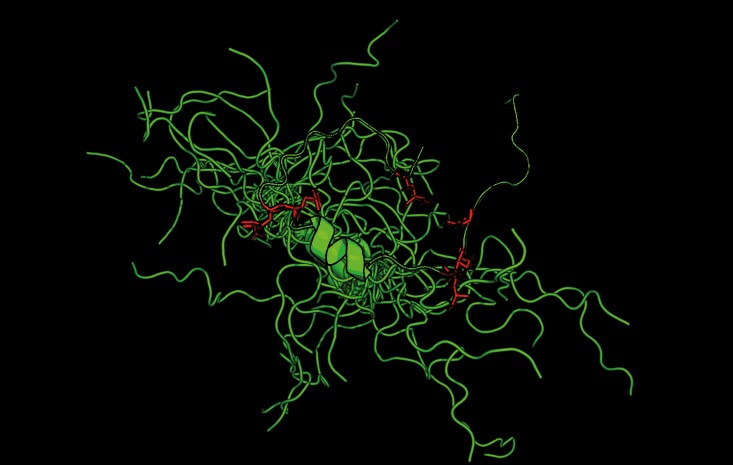
“Hemos demostrado que unas nuevas estructuras en un prionoide (proteína que adopta una estructura infectiva que se autorreplica pero que, a diferencia de un prión, no es transmisible), inducidas por modificaciones químicas irreversibles que ocurren en condiciones de estrés, alteran fuertemente los mecanismos de la proteína y su relevancia en el desarrollo de enfermedades. En concreto, la proteína TDP-43 al modificarse, presenta una vía molecular diferente a la que se pensaba hasta ahora que era el origen de su toxicidad en la esclerosis lateral amiotrófica”, explica Javier Oroz, investigador del CSIC en el Instituto de Química Física Rocasolano.
Javier Oroz (CSIC): “La proteína TDP-43 al modificarse, presenta una vía molecular diferente a la que se pensaba hasta ahora que era el origen de su toxicidad en la esclerosis lateral amiotrófica”
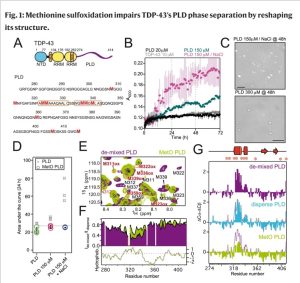 Estas nuevas estructuras, mucho más dinámicas y desordenadas, escapan del control de las chaperonas moleculares. Además, impiden la formación de condensados por separación de fases y forman unos agregados con una morfología significativamente distinta. Según Oroz, esa modificación ocurre en el desarrollo de la enfermedad y su efecto estructural es muy severo.
Estas nuevas estructuras, mucho más dinámicas y desordenadas, escapan del control de las chaperonas moleculares. Además, impiden la formación de condensados por separación de fases y forman unos agregados con una morfología significativamente distinta. Según Oroz, esa modificación ocurre en el desarrollo de la enfermedad y su efecto estructural es muy severo.
“Demostramos que es necesario tenerla en consideración si se realizan estudios de proteínas para entender los mecanismos moleculares de las enfermedades. Además, el efecto tan pronunciado de las modificaciones en la agregación de TDP-43 abre la puerta al estudio sistemático de distintas variantes de TDP-43 como reactivos de diagnóstico para la esclerosis lateral amiotrófica”, añade el investigador.
Los resultados de este estudio tienen implicaciones también en el campo de la biología estructural. Dado que la estructura de las proteínas cambia drásticamente al sufrir una modificación, estas estructuras no pueden predecirse con programas de inteligencia artificial de uso habitual en el estudio del plegamiento de proteínas como AlphaFold.