Redacción
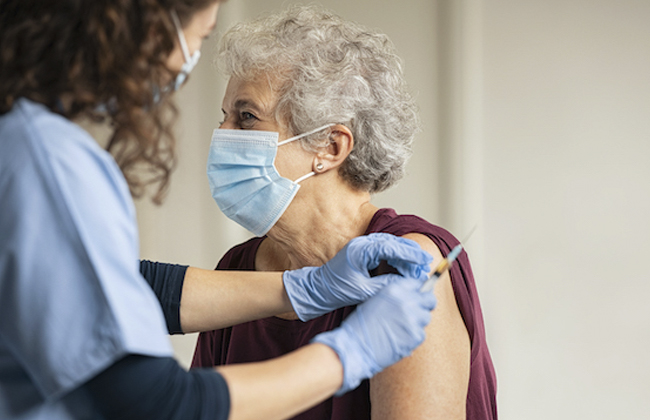
La Comisión Europea dio este martes su aprobación a la vacuna Arexvy, la primera en el mercado para proteger a los adultos mayores de 60 años frente al virus sincitial respiratorio (VRS), considerado como la causa más frecuente de bronquiolitis y neumonías.
Bruselas consideró los trámites para examinar esta vacuna para mayores de 60 frente al virus sincitial respiratorio como “prioritarios”
La comisaria de Salud, Stella Kyriakides, ha destacado la importancia de contar con una vacuna que era “especialmente esperada” por el aumento de infecciones durante el pasado invierno, al tiempo que ha destacado que Bruselas consideró los trámites para examinar esta vacuna como “prioritarios” y agilizar así el proceso.
Con todo, el Ejecutivo comunitario apunta que la autorización de la vacuna ha seguido una “estricta evaluación” bajo el mecanismo acelerado de la Agencia Europa del Medicamento (EMA, por sus siglas en inglés), conscientes de que la prevención de este virus en la población anciana es “de gran interés para la salud pública”.
La comisaria de Salud ha confiado en que los estados miembros definan estrategias nacionales de vacunación para que las personas mayores puedan recibir la vacuna “en los próximos meses”
“La pandemia de coronavirus mostró claramente la necesidad de una acción decisiva para preparar mejor a la UE frente a las amenazas sanitarias emergentes. Este es un principio fundamental de la fuerte Unión Europea de la Salud que estamos construyendo”, ha defendido Kyriakides. Según los datos de Bruselas, el VRS provoca unas 250.000 hospitalizaciones y 17.000 muertes cada año entre personas de más de 65 años en la UE.
La comisaria ha confiado también en que los gobiernos “aprovechen rápidamente” la oportunidad y definan estrategias nacionales de vacunación para que las personas con mayor riesgo puedan vacunarse “en los próximos meses”, antes de que vuelva el otoño.
GSK está haciendo ensayos adicionales para ampliar su administración a adultos de 50 a 59 años con comorbilidades subyacentes
El Comité de Medicamentos de Uso Humano (CHMP) ya dio su opinión positiva el 23 de abril para esta vacuna recombinante y adyuvada de GSK, ahora es cuando la Comisión Europea ha autorizado su comercialización. La compañía está realizando otros ensayos clínicos de fase tres adicionales para ampliar a adultos de 50 a 59 años con comorbilidades subyacentes la administración de esta vacuna y tener más evidencias sobre su administración conjunta con otras vacunas para adultos mayores.