Redacción
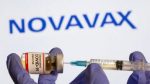
El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) recomienda autorizar la vacuna contra el Covid-19 de la farmacéutica Novavax adaptada dirigida a la subvariante Omicron XBB.1.5 (Nuvaxovid XBB.1.5). Según las recomendaciones previas de la EMA y del Centro Europeo para la Prevención y el Control de Enfermedades (ECDC), los adultos y adolescentes a partir de 12 años que requieran vacunación deben recibir una dosis única, independientemente de su historial de vacunación contra el Covid-19.
En concreto, el CHMP basa su recomendación de autorización de esta vacuna en la evaluación de los datos de laboratorio que muestran que la vacuna adaptada logra desencadenar una respuesta inmunitaria adecuada contra XBB.1.5.
La vacuna adaptada de Novavax logra desencadenar una respuesta inmunitaria adecuada contra XBB.1.5
Además, el Comité consideró datos de un estudio en adultos previamente vacunados que muestra que cuando Nuvaxovid se adaptó para atacar otra cepa relacionada, Omicron BA.5, pudo desencadenar una fuerte respuesta inmune contra esta cepa. De esta forma, el CHMP espera que la vacuna de Novavax desencadene una respuesta inmunitaria adecuada contra XBB.1.5.
Por otro lado, consideran que el perfil de seguridad de Nuvaxovid XBB.1.5 sea similar al del Nuvaxovid, autorizado originalmente. Esto también se respaldó mediante los datos clínicos disponibles con la versión de la vacuna dirigida a Omicron BA.5. Por último, los efectos secundarios más comunes de Nuvaxovid XBB.1.5 son dolor y sensibilidad en el lugar de la inyección, cansancio, dolor de cabeza, dolor muscular y malestar general.