Redacción
GenesisCare incorpora al Dr. Fernando López Campos a su equipo de radioterapia de Madrid

GenesisCare anuncia la incorporación del Dr. López Campos a su equipo médico de Madrid. El doctor comenzará a trabajar en el servicio de oncología radioterápica, con el objetivo de fortalecer e impulsar la atención oncológica en tumores genitourinarios y gastrointestinales. Desde 2014, el Dr. López Campos forma parte integral de la Unidad de Tumores Genitourinarios y Tumores Gastrointestinales del Hospital Universitario Ramón y Cajal, donde ha combinado su labor asistencial con una activa participación en proyectos de investigación. Ha participado en numerosos ensayos clínicos tanto a nivel nacional como internacional, adquiriendo una amplia experiencia en este campo.
Además de su destacado trabajo clínico, el Dr. López Campos se ha distinguido como ponente en diversos foros nacionales e internacionales, compartiendo sus conocimientos y perspectivas en la comunidad médica. Actualmente, ejerce como miembro de la Junta Directiva del Instituto de Investigación en Oncología Radioterápica (IRAD) y del Grupo Español Multidisciplinar en Cáncer Digestivo. Además, por otro lado, desempeña el rol de Coordinador del grupo de Tumores Genitourinarios de la Sociedad Española de Oncología Radioterápica.
GSK lanza la VI convocatoria de su Premio al Periodismo en Respiratorio ‘Innovación que se respira’
GSK mantiene su compromiso con el área de Respiratorio desde hace más de 50 años, tanto con los profesionales sanitarios como con los pacientes, ofreciendo alternativas innovadoras que permiten mejorar la calidad de vida de las personas con patologías respiratorias como el asma y la enfermedad pulmonar obstructiva crónica (epoc). Dentro de las muchas iniciativas que la compañía ha puesto en marcha a lo largo de estos años, surgió en el año 2018 el proyecto del Premio al Periodismo en Respiratorio `Innovación que se respira´. El objetivo de esta iniciativa es reconocer la labor de periodistas y medios de comunicación que, con su trabajo, contribuyen en la difusión del conocimiento sobre el asma y la EPOC, así como de otros aspectos que rodean a estas patologías: avances terapéuticos, aspectos ligados a la calidad de vida de los pacientes, investigación básica y traslacional, aspectos sociales, laborales o médicos, etc. De esta manera permite dar visibilidad a estas patologías, conocerlas en profundidad y ayudar a mejorar la calidad de vida de las personas que las padecen.
La V edición del Premio al Periodismo en Respiratorio ‘Innovación que se respira’ contó con una participación récord de 34 periodistas que presentaron un total de 55 trabajos publicados entre septiembre de 2022 y septiembre de 2023. La elevada cifra de participantes demuestra que, a lo largo de estos años, este galardón se ha ido consolidando como referente dentro del sector y es por lo que GSK abre un año más el plazo de presentación de candidaturas de su VI edición.
El premio consta de una única categoría que agrupa a medios escritos y audiovisuales. Podrán presentarse todos aquellos trabajos que hayan sido publicados o emitidos en un medio de comunicación entre el 1 de septiembre de 2023 y el 15 de junio de 2024, y la fecha límite de recepción de los mismos será hasta el 15 de junio de 2024 a través de la Secretaría Técnica. El trabajo seleccionado estará retribuido con 3.000 euros y, en el caso de la mención de honor, recibirá 1.500 euros.
Grupo Italfarmaco recibe la aprobación de la FDA para exportar sus medicamentos al mercado norteamericano

Grupo Italfarmaco ha recibido la comunicación oficial de la Food and Drug Administration (FDA) que habilita su planta de producción en España para exportar medicamentos al mercado norteamericano. Con esta aprobación, Grupo Italfarmaco marca un hito en su historia, ya que la FDA es conocida por imponer los estándares más rigurosos de calidad. Esta aprobación implica el reconocimiento de la calidad en la planta que Grupo Italfarmaco tiene en Alcobendas (Madrid), y supone también un reconocimiento a la dedicación y el compromiso de cada uno de sus empleados a lo largo de los años.
Como explica Álvaro Acebrón, director general de Grupo Italfarmaco en España “ahora nos enfrentamos a un nuevo desafío: mantener este exigente estándar a lo largo de los años. La aprobación de la FDA es solo el comienzo de una nueva fase en la que debemos demostrar constantemente nuestro compromiso con la excelencia y la calidad. Este éxito no solo es un reconocimiento, sino también una gran responsabilidad.”
Dentro de las instalaciones del Grupo en Alcobendas hay dos plantas de producción diferenciadas, una para líquidos y sólidos orales y otra planta de semi sólidos, que están sometidas a los más estrictos controles de calidad. La compañía cuenta además con un equipo dedicado a la I+D, formado por más de 40 profesionales, que trabajan en el desarrollo de tecnología, proyectos y ensayos clínicos en colaboración con hospitales y centros de investigación de toda España. Con una extensión de 4.000 m2, tiene un volumen de producción de 3.500 toneladas de más de 55 productos diferentes, entre los que se encuentra la producción de más de 20 millones de unidades de producto terminado en distintas formas farmacéuticas.
El 70% de la producción de la planta de Madrid está destinada a la exportación internacional, para los más de 35 países con los que la compañía trabaja en todo el mundo, como Francia, Alemania, Suecia, Portugal, China, Turquía, Marruecos, Argelia, Vietnam, Méjico o Perú, entre otros, y a los que ahora se suma Estados Unidos.
El Consejo de Ministros aprueba 15,5 millones para que comunidades autónomas e Ingesa adquieran 61 equipos de mamografía
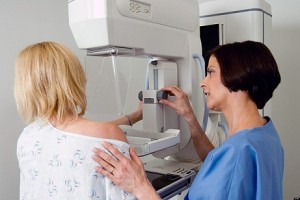
El Consejo de Ministros ha aprobado un acuerdo marco que posibilitará que varias comunidades y ciudades autónomas adquieran un total de 61 equipos de mamografía, por un importe total de 15.546.094 euros. La formalización de los contratos está prevista en 2024. Son un total de seis Acuerdos Marco, por un valor estimado total de 266.751.822 euros, siendo la Dirección del Ingesa el órgano de contratación, y en la elaboración de las prescripciones técnicas han colaborado un grupo de expertos pertenecientes a los servicios de salud de diferentes comunidades autónomas, los cuales participarán asimismo en la valoración técnica de las proposiciones.
Este acuerdo se incluye en el Plan de Acuerdos Marco de Equipos de Alta Tecnología Sanitaria del Ingesa (Plan AMAT-I), que pretende dar continuidad a los objetivos que se fijaron con el Plan Inveat de reducir la obsolescencia del parque tecnológico de equipos de alta tecnología del Sistema Nacional de Salud (SNS), así como aumentar las capacidades diagnósticas de los centros del SNS mediante la mejora de la banda tecnológica de los equipos a renovar y ampliar el parque tecnológico.
Una parte importante de los equipos de diagnóstico por la imagen, tales como los equipos de radiología convencional, de mamografía y de ecografía, no se pudieron incluir en el Plan Inveat y, según la literatura científica, más del 50% de los equipos de radiología convencional llevan más de 10 años instalados y, de estos, más de la mitad están basados en tecnología analógica para la obtención de la imagen, lo que limita mucho la implementación y utilización de las nuevas tecnologías de gestión y distribución de imágenes.
Elinzanetant de Bayer cumple con todos los objetivos clave en los estudios clínicos de fase III Oasis 1 y 2

Bayer ha anunciado resultados positivos de primera línea de los estudios pivotales de fase III Oasis 1 y 2, que evaluaron la eficacia y seguridad del compuesto en investigación elinzanetant frente a un placebo. Elinzanetant cumplió exitosamente los cuatro criterios de valoración principales en ambos estudios, demostrando reducciones estadísticamente significativas en la frecuencia e intensidad de los síntomas vasomotores (SVM) moderados e intensos (también conocidos como sofocos) desde el inicio del tratamiento hasta las semanas 4 y 12 en comparación con el placebo.
En ambos estudios también se alcanzaron los tres criterios de valoración secundarios clave, observándose una reducción estadísticamente significativa de la frecuencia de los SVM desde el inicio hasta la semana 1, así como mejoras estadísticamente significativas en los trastornos del sueño y la calidad de vida relacionada con la menopausia en comparación con placebo. El perfil de seguridad observado en los estudios Oasis 1 y 2 es en general consistente con los datos previamente publicados1,2 sobre elinzanetant.
“Estamos entusiasmados con los resultados positivos de estos dos estudios pivotales de fase III con elinzanetant, que refuerzan su potencial como opción de tratamiento no hormonal en el abordaje de la menopausia”, señala el Dr. Christian Rommel, miembro del comité ejecutivo de la División Farmacéutica de Bayer AG y Jefe de Investigación y Desarrollo a nivel mundial. “Queremos agradecer a las mujeres que participan en los estudios, a sus familias y a todos los investigadores, así como a su personal clínico y de enfermería, su tiempo y compromiso para avanzar en la investigación de la menopausia”. Elinzanetant es un primer antagonista dual del receptor de neurocinina-1,3 (NK-1,3), que está en una fase avanzada de desarrollo clínico para el tratamiento no hormonal de los SVM moderados o intensos asociados a la menopausia, que se administra por vía oral.
Fedifar traslada a Asturias su compromiso con la equidad en el acceso de los ciudadanos a los medicamentos

La presidenta de la Federación de Distribuidores Farmacéuticos (Fedifar), Matilde Sánchez Reyes, ha mantenido un encuentro institucional con la consejera de Salud del Principado de Asturias, María Concepción Saavedra, en el que ha destaca el compromiso de todos los mayoristas farmacéuticos de gama completa que actúan en esta comunidad con la protección de la salud de los ciudadanos asturianos. “La experiencia y la capacidad con la que cuentan los asociados a Fedifar es un pilar fundamental para mantener una red capilar de farmacias que permite el acceso de todos los ciudadanos a los medicamentos que necesitan, con independencia del tamaño o de la ubicación del concejo en el que vivan”, han asegurado Sánchez Reyes.
Sánchez Reyes ha recordado que garantizar a todos los ciudadanos la equidad en el acceso a los medicamentos y productos sanitarios a través de las farmacias es una máxima que, desde hace un siglo, guía el trabajo diario de las empresas de distribución farmacéutica de gama completa que operan en España. Una labor que cobra aún más importancia en regiones que, como el Principado de Asturias, cuentan con un alto porcentaje de farmacias ubicadas en pequeños municipios (de las 455 existentes en esta comunidad, 47 se encuentran en concejos de entre 800 y 5.000 habitantes y siete en municipios con menos de 800 vecinos) o que registran altos promedios de habitantes mayores de 65 años por farmacia (en Asturias el 27,2%).
“Los distribuidores farmacéuticos de gama completa no podemos resolver un problema que afecta a nivel mundial y cuyas causas son ajenas a nuestra actividad, pero sí tenemos herramientas que pueden ayudar a mitigar los efectos negativos que tienen sobre los pacientes”, ha expuesto Sánchez Reyes a la consejera. Sobre este particular, resaltó tres activos con los que cuentan los asociados a Fedifar: la detección temprana a través del sistema Artemis; la información sobre posibles incidencias que pueden poner a disposición de las autoridades sanitarias; y la gestión de la escasez mediante una distribución equitativa que evite acopios.
Sobre este último recurso, Sánchez Reyes subrayó la conveniencia de que la actividad de las distribuidoras de gama completa sea reconocida y diferenciada de la de otros operadores que realizan una labor totalmente diferente pero que operan en el mercado con la misma licencia. “Esta diferenciación ayudaría a que en situaciones excepcionales de escasez se pudiese priorizar el abastecimiento por parte de los laboratorios de los medicamentos afectados a las empresas de distribución farmacéutica de gama completa para que éstas realicen una gestión eficiente y equitativa de los stocks existentes”, ha concluido.












