Gema Maldonado
¿Se puede dirigir una especie de “bomba” al interior de un tumor a través de nanorrobots que pueden autopropulsarse a lo largo y ancho de un órgano para encontrar el tumor, entrar en él y soltar los fármacos que lo destruyan? Se puede. No es como alguna película de ciencia ficción adelantaba hace años, dejando en nuestro imaginario aquella visión de micronaves que recorrían el cuerpo, pero un equipo de investigadores en España ha conseguido que sus nanorrobots cargados de radioyodo hayan acabado con el 90% de los tumores de vejiga en ratones. Su investigación y sus resultados les han valido la publicación en Nature Nanotechnology.
El laboratorio de Samuel Sánchez en el IBEC, al que pertenece la investigadora Meritxell Serra, ha liderado el trabajo. Ambos son los primeros autores del estudio y, para comprender mejor cómo funciona esta tecnología y lo que pude suponer la nanomedicina para el tratamiento de distintas enfermedades, hemos conversado con la investigadora, involucrada en distintos proyectos con nanorrobots que puedan cambiar formas de tratamiento y mejorar la eficiencia de los fármacos.
“Como la reacción a propulsión de un coche, que usa la gasolina para moverse, nuestros nanorrobots usan la urea para descomponerla y moverse”
¿Por qué han desarrollado esta investigación en concreto para cáncer de vejiga?
Porque era el escenario ideal, ya que los nanorrobots que usamos se mueven gracias a una enzima que se llama ureasa que descompone la urea, que se encuentra en la orina. Esta reacción química es como la reacción a propulsión de un coche, que usa la gasolina para moverse. Nuestros nanorrobots usan la urea para descomponerla y moverse. Así que el cáncer de vejiga era ese escenario ideal, porque ya contiene el combustible de los nanrrobots.
¿Qué características tiene el material que forma los nanorrobots y cómo saben si un material es adecuado o no?
La nanopartícula es de silica, un material que se encuentra como componente, por ejemplo, de la arena. Lo usamos porque es muy poroso, lo que nos da ciertas ventajas a la hora de poder cargar fármacos dentro de esos poros. Pero también lo usamos porque teníamos estudios previos desde 2017 donde veíamos que eran capaces de transportar quimioterapia y hacerlo de manera más eficiente que las nanopartículas sin propulsión, y también podían penetrar pequeños minitumores fuera de un ser vivo, en el laboratorio.

Habíamos visto que funcionaban muy bien y no daban toxicidad, por eso continuamos con ese tipo de partículas. Pero también estamos investigando otros materiales, por ejemplo, algunos que ya estén aprobados por la Agencia Europea del Medicamento o por la FDA en Estados Unidos para facilitarnos después el paso a ensayos clínicos.
“Nuestra tecnología tiene tres piezas: el “chasis”, que sería la nanopartícula, el “motor”, que sería la ureasa y el agente terapéutico. Las tres piezas son bastante moldeables y adaptables a cada situación”
Entonces, ¿podrían llegar a cambiar el tipo de material en los siguientes pasos de la investigación?
Exacto, porque tenemos una tecnología compuesta por distintos “paquetes”, por decirlo así. Uno es el “chasis”, como si fuera el de un coche, y sería la nanopartícula de sílica en este caso, pero podría ser de otro material, lo podemos cambiar. Después hay una parte que actúa como el “motor del coche”, que sería la ureasa y que sí se mantendría para tener el mismo efecto de propulsión. Y, en tercer lugar, tenemos el agente terapéutico, que podemos cambiarlo también.
En este caso hemos usado radioyodo, pero también hemos usado con anterioridad quimioterapia que estamos explorando en paralelo en ensayos con ratones. Así que las tres piezas de la tecnología son bastante moldeables y adaptables a cada situación.
¿Qué es lo que hace que los nanorrobots se dirijan al tumor y sean capaz de soltar dentro la radioterapia que transportan?
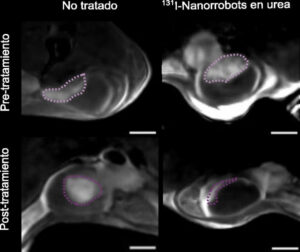
Hemos visto que al descomponer la urea, que está presenten en la orina, se produce un cambio de PH y, este cambio, que es muy localizado porque se produce alrededor de los nanorrobots, es capaz de degradar la matriz extracelular, es decir, la pared del tumor cuando los nanorrobots se acercan a él. Por eso penetran en el tumor y no en el tejido sano. Este es el mecanismo que hace que hasta el 95% de los nanobots se acumulen en el tumor y solo un 5% lo haga en epitelio sano. De esta forma el radiofármaco que llevan encima hace efecto solo en la zona tumoral.
“En este caso hemos usado radioyodo, pero también hemos usado con anterioridad quimioterapia que estamos explorando en paralelo en ensayos con ratones”
Con una dosis se redujo el 90% del volumen de esos tumores en los ratones investigados. ¿Se plantean si una segunda dosis acabaría con el tumor?
Tenemos otros estudios en paralelo para ver cuántas administraciones son necesarias hasta erradicar completamente el tumor y comprobar si hay recaídas, es decir, si el tumor vuelve a aparecer al cabo de un tiempo.
¿Qué pasos son los siguientes en esta investigación?
Nuestro grupo de investigación creó en enero de 2023 Nanobots Therapeutics, una empresa spin-off del grupo, con el objetivo de intentar impulsar esta tecnología hacia el mercado. Y el primer paso sería poder entrar en ensayos clínicos. Para ello están levantando capital y pidiendo financiación con el fin de poder pasar todas las fases del proceso regulatorio y todos los estudios preclínicos que faltan una vez que tenemos esta evidencia para poder llegar a ensayos clínicos.
“Calculamos que en unos cuatro o cinco años podríamos llegar a ensayos clínicos con los nanorrobots”
Calculamos que en unos cuatro o cinco años podríamos llegar a ensayos, porque el radiofármaco ya está probado en cáncer de tiroides; si cambiamos el “chasis” por un material que ya esté aprobado por la agencia regulatoria y demostramos que la combinación de estos elementos es segura seguramente nos facilitará el trabajo para llegar a esa fase I de ensayos.
¿Sería posible que funcionaran para otros tipos de cáncer?
Sí sería posible. Como parte de mi tesis doctoral estoy involucrada en un proyecto con el Hospital Vall d’Hebron de Barcelona, donde estamos intentando usar los nanobots, aunque ligeramente distintos porque les cambiamos el “motor”: como en el resto del cuerpo no tenemos urea, utilizamos otra enzima que nos permita también propulsar los nanobots. Estos tratamientos siempre los hacemos de forma localizada, es decir, no se inyecten en la sangre por vía intravenosa y recorren el torrente sanguíneo. Ahora los estamos estudiando para tumores gastrointestinales.
“Investigamos materiales que no sean tóxicos y que sean buenos transportadores de fármacos, ya que muchos son muy difíciles de disolver en agua”
¿Qué implicaciones puede tener para la nanomedicina hallar materiales seguros y que puedan ser buenos conductores para llevar medicamentos a la zona dónde hacen falta?
Los dos factores que más nos interesan son, por un lado, que no sean tóxicos, que no causen efectos secundarios y, por otro lado, que sean buenos transportadores, ya que muchos fármacos son muy difíciles de disolver en agua. Por ejemplo, en la vacuna Covid-19 de Moderna, han utilizado una nanopartícula lipídica que lleva dentro el RNA. En cada caso, podemos ir cambiando el material de la nanopartícula para adaptarlo al fármaco que transporta. Así, si tenemos un fármaco que no se disuelve bien en agua, necesitamos una nanopartícula que sea capaz de encapsularlo y que pueda disolverse bien.
¿Cómo cree que va a influir en los próximos años la nanomedicina en el abordaje y en el tratamiento de enfermedades?
En todas esas situaciones donde los fármacos de hoy en día no son suficientemente eficientes porque tienen que atravesar barreras biológicas en el cuerpo, como puede ser cruzar una barrera de moco o la barrera hematoencefálica del cerebro, la nanomedicina puede mejorar la llegada del fármaco. A la vez, como el fármaco no está expuesto, puede reducir mucho sus efectos secundarios.
“Como los fármacos en nanorrobots no están exupuestos, puede reducir mucho sus efectos secundarios”
¿Permitirá ir hacia unas terapias más dirigidas y también más personalizadas?
Así es, pero hace falta bastante inversión en el desarrollo de la nanomedicina que sea más adecuada para cada tipo de enfermedad, porque cada persona tiene sus propias complicaciones y su propio tratamiento. No vamos a tener una única nanopartícula que lo cure todo, ni tan solo un único nanorrobot que cubra todos los tipos de cáncer, sino que hay que seguir investigando. Pero son muy prometedores.