Gema Maldonado
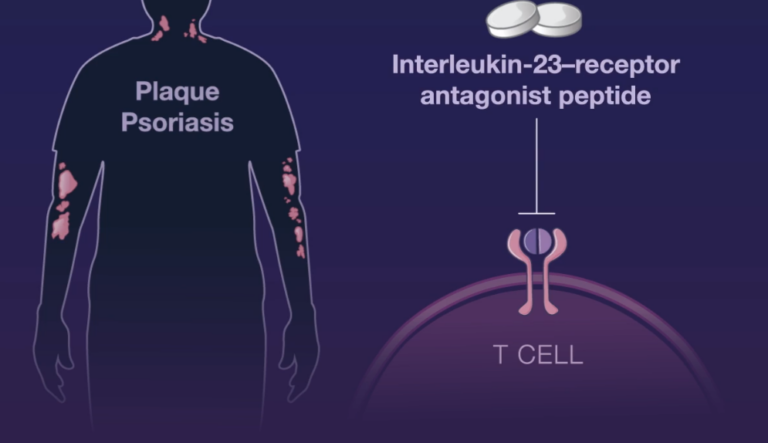
Un péptido dirigido a bloquear el receptor de la IL-23, el primero de este tipo y con administración oral, ha obtenido buenos resultados en el ensayo de fase 2b Frontier 1 sobre pacientes con psoriasis en placas de moderada a grave. Los resultados del ensayo, publicados en la revista The New England Journal of Medicine, indican que los pacientes alcanzaron una respuesta PASI 75 significativa, dependiente de la dosis en la semana 16 en comparación con los pacientes tratados con placebo, con un 79% de ellos que alcanzaron una respuesta PASI 75 en el grupo de la dosis más alta probada de 100 mg dos veces al día.
Los pacientes con psoriasis que recibieron la dosis más alta del péptido dirigido JNJ-2113 alcanzaron una respuesta PASI 100 del 40% y una IGA 0 (aclaramiento completo) del 45%
Los datos fueron coherentes con los criterios de valoración secundarios, de modo que los pacientes que recibieron la dosis más alta de JNJ-2113 alcanzaron una respuesta PASI 100 del 40% y una IGA 0 (aclaramiento completo) del 45%. “Los datos del estudio son muy alentadores para el programa de desarrollo clínico en curso y ofrecen razones para confiar en poder seguir investigando el agente experimental JNJ-2113 como tratamiento oral que pueda suponer una opción terapéutica atractiva y cómoda para los pacientes”, ha señalado el Dr. Robert Bissonnette, director ejecutivo y médico de Innovaderm Research en Montreal (Canadá).
Las mejoras también fueron coherentes con los resultados que reportaron los propios pacientes hasta la semana 16. Los pacientes tratados con el péptido presentaron una mejoría superior respecto al inicio en la gravedad de los síntomas relacionados con la enfermedad, según la evaluación del diario de síntomas y signos de la psoriasis (PSSD). Entre los pacientes con puntuaciones basales superiores a 1 en el índice dermatológico de calidad de vida (DLQI), la proporción de pacientes tratados con JNJ-2113 que alcanzaron puntuaciones del DLQI de 0/1 (sin impacto en la calidad de vida) en la semana 16 fue superior a la de los tratados con placebo.
Dr. Bissonnette: “Los datos del estudio son muy alentadores y ofrecen razones para confiar en poder seguir investigando JNJ-2113 como tratamiento oral que pueda suponer una opción terapéutica atractiva y cómoda para los pacientes”
La IL-23 desempeña un papel esencial en la activación patogénica de los linfocitos T en la psoriasis en placas de moderada a grave y sustenta la respuesta inflamatoria en la psoriasis y en otras enfermedades dermatológicas y gastroenterológicas mediadas por la IL-23.
“El conocimiento científico que respalda los tratamientos avanzados para las enfermedades inflamatorias inmunomediadas, como la psoriasis, ha avanzado en las últimas décadas y los pacientes desean poder contar con opciones terapéuticas que combinen la eficacia de los tratamientos de referencia con un perfil de seguridad aceptable y con vías de administración flexibles”, ha señalado el Dr. Bissonnette.
En este estudio fase 2, las tasas de acontecimientos adversos (AA) fueron en general similares entre los grupos tratados con JNJ-2113 y con placebo. Los más frecuentes (≥5% de cualquier grupo de tratamiento) fueron infección por Covid-19, nasofaringitis, infección de vías respiratorias altas, diarrea, cefalea y tos. No se observó ninguna relación entre el grupo que recibió JNJ-2113 y la aparición de acontecimientos adversos graves.
Dr. Lloyd Miller: “Si se aprueba, JNJ-2113 puede llegar a mejorar tanto los resultados clínicos como la calidad de vida de los pacientes”
El tratamiento con JNJ-2113 también se asoció con niveles séricos más bajos de beta-defensina 2 (hBD-2) en comparación con placebo, ya desde la semana 4. El nivel más bajo de hBD-2 se observó con la dosis de 100 mg dos veces al día, a partir de la semana 8. Anteriormente se había observado que niveles más bajos de hBD-2 se correlacionan con respuesta clínica e indican inhibición del eje IL-17/IL-23.
“Si se aprueba, JNJ-2113 puede llegar a mejorar tanto los resultados clínicos como la calidad de vida de los pacientes”, ha asegurado el Dr. Lloyd Miller, vicepresidente y jefe del área terapéutica de Inmunodermatología de Johnson & Johnson Innovative Medicine.
Los resultados del ensayo clínico Frontier 1 sugieren el potencial de JNJ-2113 en todo el espectro de enfermedades adicionales mediadas por la IL-23. En este sentido, la compañía ha iniciado el estudio Anthem-UC fase 2b para evaluar la seguridad y eficacia de JNJ-2113 en comparación con placebo en participantes con colitis ulcerosa de actividad moderada a grave. Además están en marcha y a punto de empezar otros estudios con este mismo péptido.