Redacción
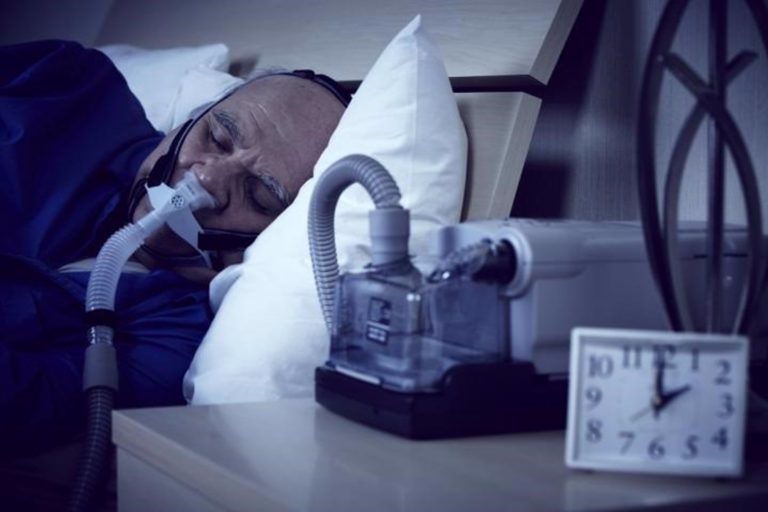
Eli Lilly and Company ha anunciado los resultados positivos de dos ensayos clínicos de fase 3 Surmount-osa, que mostraron que el uso de tirzepatida (10 mg o 15 mg) redujo significativamente el índice de apnea-hipopnea (IAH) en comparación con placebo, alcanzando los criterios de valoración primarios. El cambio porcentual del IAH fue un criterio de valoración secundario clave en ambos estudios. El IAH registra el número de veces que la respiración de una persona muestra un bloqueo restringido o completo del flujo de aire por hora de sueño, y se utiliza para evaluar la gravedad de la apnea obstructiva del sueño (AOS) y la eficacia de los tratamientos. Tirzepatida es el único fármaco agonista de los receptores de GIP (polipéptido insulinotrópico dependiente de la glucosa) y de GLP-1 (péptido similar al glucagón-1) autorizado en personas con obesidad para el control del peso.
En el estudio Surmount-osa 1, para la estimación de la eficacia, a las 52 semanas, se observó una reducción media del IAH con respecto al valor inicial de 27,4 eventos por hora
El estudio Surmount-osa 1 evaluó el uso de tirzepatida en adultos con AOS de moderada a grave y obesidad que no recibían tratamiento con presión positiva en las vías respiratorias (PAP) durante 52 semanas. Para la estimación de la eficacia, a las 52 semanas, se observó una reducción media del IAH con respecto al valor inicial de 27,4 eventos por hora, frente a una reducción media del IAH con respecto al valor basal de 4,8 eventos por hora para el grupo de placebo. En cuanto a los criterios de valoración secundarios clave como el cambio porcentual en el IAH desde el inicio, se observó una reducción media del 55% con tirzepatida frente al 5% con placebo; además, con tirzepatida se observó una reducción media del peso corporal del 18,1% con respecto al valor inicial, frente al 1,3% con placebo.
En el estudio Surmount-osa 1, tirzepatida se observó una reducción media del peso corporal del 18,1% con respecto al valor inicial, frente al 1,3% con placebo
El estudio Surmount-osa 2 evaluó el uso de tirzepatida en adultos con AOS moderada a grave y obesidad en tratamiento con PAP que tenían previsto continuar usando la terapia PAP durante 52 semanas. Para la estimación de la eficacia, a las 52 semanas, con tirzepatida se observó una reducción media del IAH, respecto al valor al inicio, de 30,4 eventos por hora, en comparación con una reducción de 6 eventos por hora con placebo frente al valor al inicio. En los criterios de valoración secundarios clave, como el cambio porcentual en el IAH desde el inicio, con tirzepatida se consiguió una reducción media del 62,8% en comparación con el 6,4% con placebo. Asimismo, con tirzepatida se obtuvo una reducción media del peso corporal del 20,1% desde el inicio, en comparación con el 2,3% con placebo.
La apnea obstructiva del sueño es un trastorno respiratorio relacionado con el sueño caracterizado por bloqueos completos o parciales de las vías respiratorias superiores durante el sueño, lo que puede provocar apnea o hipopnea y una posible disminución de la saturación de oxígeno y/o despertar del sueño. La AOS puede tener complicaciones cardiometabólicas graves y provocar hipertensión, enfermedad coronaria, accidentes cerebrovasculares, insuficiencia cardíaca, fibrilación auricular y diabetes tipo 2.
Para la estimación de la eficacia, a las 52 semanas, con tirzepatida se observó una reducción media del IAH, respecto al valor al inicio, de 30,4 eventos por hora
“La apnea obstructiva del sueño afecta a 80 millones de adultos en EE. UU., y más de 20 millones viven con esta patología de moderada a grave. Sin embargo, el 85% de los casos no se diagnostican y, por lo tanto, no se tratan“, dijo Jeff Emmick, MD, Ph.D., vicepresidente sénior de desarrollo de productos de Lilly.
Los ensayos clínicos Surmount-osa se presentarán durante un simposio en la 84ª Sesión Científica de la Asociación Americana de Diabetes (ADA) el 21 de junio y se enviarán a una revista revisada por pares para su posterior publicación.