Redacción
La FDA aprueba la jeringa precargada (PFS) de faricimab (Vabysmo) para tres de las principales causas de pérdida de visión

Roche ha anunciado que la Agencia Americana del Medicamento (FDA, por sus siglas en inglés) ha aprobado el uso de faricimab (Vabysmo) 6.0 mg en jeringa precargada (PFS) en monodosis para el tratamiento de la Degeneración Macular neovascular o “húmeda” asociada a la edad (DMAEn), el Edema Macular Diabético (EMD) y el EM secundario a la Oclusión Venosa Retiniana (OVR). En conjunto, estas tres enfermedades afectan a cerca de 80 millones de personas en todo el mundo. Vabysmo PFS estará disponible en EE.UU. para los profesionales sanitarios expertos en retina y sus pacientes en los próximos meses.
Tal y como ha señalado el Dr. Levi Garraway, director médico y jefe de Desarrollo Global de Productos de Roche, “estamos muy orgullosos de que la FDA haya aprobado este tratamiento en PFS para las personas que padecen DMAEn, EMD y edema por OVR, que son algunas de las principales causas de pérdida de visión. Aunque muchos especialistas en retina ya utilizan esta terapia en primera línea, esta nueva forma de administración debería simplificar aún más su administración, mejorando así la experiencia de tratamiento, tanto para los médicos como para los pacientes”.
Osimertinib con quimioterapia, aprobado en la UE como nuevo tratamiento de 1ª línea para pacientes con cáncer de pulmón avanzado

Osimertinib (Tagrisso) de AstraZeneca, junto con pemetrexed y quimioterapia basada en platino, ha sido aprobado en la Unión Europea (UE) para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón no microcítico (CPNM) avanzado con mutación del receptor del factor de crecimiento epidérmico (mEGFR) cuyos tumores presentan deleciones del exón 19 o mutaciones del exón 21 (L858R).
La aprobación de la Comisión Europea sigue a la opinión positiva del Comité de Medicamentos de Uso Humano (CHMP) y se basa en los resultados del ensayo de fase III Flaura22 publicados en The New England Journal of Medicine.
En el ensayo, el tratamiento sumado a la quimioterapia, redujo el riesgo de progresión de la enfermedad o muerte en un 38%, según la evaluación de los investigadores, en comparación con el tratamiento en monoterapia (Hazard ratio [HR] 0,62; intervalo de confianza [IC] del 95%: 0,49-0,79; p<0,0001). La mediana de la supervivencia libre de progresión (SLP) fue de 25,5 meses para los pacientes tratados con el inhibidor del EGFR más quimioterapia, una mejora de 8,8 meses frente a la monoterapia con este fármaco (16,7 meses).
Zhiyi Biotech completa con éxito el ensayo clínico de fase I de SK10

Zhiyi Biotech anunció hoy los resultados positivos de un ensayo clínico de fase 1 en EE.UU. de SK10. SK10 es un innovador producto de Bacteroides fragilis inactivado por calor para la diarrea inducida por quimioterapia (CID).
Se realizó un estudio clínico aleatorio, doble ciego, controlado con placebo y de aumento secuencial de dosis para evaluar la seguridad y tolerabilidad de SK10 en sujetos adultos sanos. Se inscribió a un total de 24 sujetos sanos en el estudio. Todos los grupos de dosis de SK10 fueron generalmente seguros y bien tolerados. Todos los eventos adversos emergentes del tratamiento fueron leves en gravedad sin aumento dependiente de la dosis.
La modificación de un fármaco de quimioterapia ofrece esperanza a las personas con tumores cerebrales y de columna raros
Cada año se diagnostican casi 100.000 casos nuevos de tumores primarios de encéfalo y columna vertebral en los Estados Unidos. Aproximadamente el 30% de estos tumores del sistema nervioso central (SNC) son malignos. Algunos de estos tumores, como un nuevo subtipo de ependimoma y algunos meduloblastomas, contienen cambios en los genes llamados MYC y MYCN. Los tumores con estas alteraciones genéticas alguna vez se consideraron “no farmacológicos”. Sin embargo, una quimioterapia llamada PLX038 puede dañar el ADN dentro de las células cancerosas para controlar o prevenir su crecimiento.
En un nuevo ensayo clínico de fase 1/2 dirigido por NCI-Connect, se está evaluando si PLX038 puede tratar a adultos con cánceres primarios del SNC con copias adicionales de MYC y MYCN (llamados tumores “amplificados” MYC y MYCN). PLX038 se ha probado en otros ensayos clínicos iniciales en tumores sólidos fuera del SNC, como el cáncer de ovario y pulmón. Sin embargo, el ensayo clínico de NCI-Connect será el primero en probar esta quimioterapia en personas con tumores del SNC.
Theraclion comunica que el estudio pivotal de la FDA para Sonovein ha finalizado con éxito
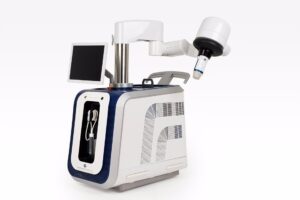
La compañía Theraclion ha comunicado que los tratamientos en el estudio pivotal de la Administración de Alimentos y Medicamentos de los EEUU (FDA) para Sonovein han concluido con éxito y según el calendario previsto.
Theraclion ha informado que Sonovein “es el método más innovador para la eliminación de las varices, que ha cambiado el estándar actual de cirugía venosa por un método extracorpóreo no invasivo”. Theraclion asegura que se trata de un método más suave, que evita la cirugía, sin incisiones ni cicatrices. El tratamiento se lleva a cabo con el dispositivo robotizado Sonovein, diseñado por la empresa francesa. Este dispositivo combina terapia e imagen en una única solución, empleando los ultrasonidos focalizados de alta intensidad (HIFU) para el tratamiento, junto con ultrasonidos de ecografía para el seguimiento de la intervención.











