Redacción
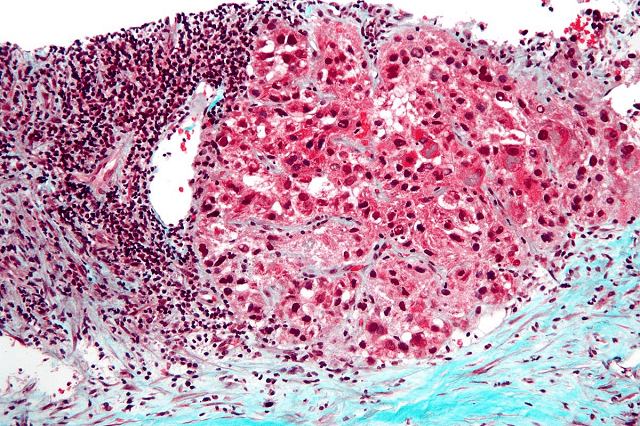
MSD ha anunciado que la Comisión Europea (CE) ha aprobado el uso de Keytruda, su terapia anti-PD-1, en combinación con enfortumab vedotin-ejfv (Padcev), un anticuerpo conjugado, para el tratamiento de primera línea en pacientes adultos con carcinoma urotelial irresecable o metastásico. Esta aprobación sigue las recomendaciones de las guías clínicas de la Sociedad Europea de Oncología Médica y la Asociación Europea de Urología, que sugieren esta combinación como tratamiento de primera elección, independientemente de la elegibilidad del paciente para el tratamiento con platino.
La decisión de la CE también sigue la opinión favorable emitida en julio de 2024 por el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos, respaldada por los resultados del análisis intermedio del ensayo clínico de fase 3 Keynote-A39 (también conocido como EV-302). Este estudio, realizado en colaboración con Pfizer (Seagen) y Astellas, demostró que la combinación de pembrolizumab y enfortumab vedotin mejoró significativamente la supervivencia global (SG) y la supervivencia libre de progresión (SLP) en comparación con la quimioterapia basada en platino (gemcitabina más cisplatino o carboplatino).
La combinación de pembrolizumab y enfortumab vedotin redujo el riesgo de muerte en un 53% en comparación con la quimioterapia con platino
Con una mediana de seguimiento de 17,3 meses (rango de 0,3 a 37,2 meses), la combinación de pembrolizumab y enfortumab vedotin redujo el riesgo de muerte en un 53% (HR=0,47 [IC del 95%, 0,38-0,58]; p<0,00001) en comparación con la quimioterapia con platino, con 133/442 (30%) eventos observados frente a 226/444 (51%). También se observó una reducción del 55% en el riesgo de progresión o muerte (HR=0,45 [IC del 95%, 0,38-0,54]; p<0,00001), con 223/442 (50%) eventos en comparación con 307/444 (69%) en el grupo de quimioterapia.
La Dra. Marjorie Green, vicepresidenta senior y directora de oncología y desarrollo clínico en MSD Research Laboratories, afirmó que esta decisión ofrece a los pacientes adultos con carcinoma urotelial irresecable o metastásico una nueva opción de tratamiento de primera línea que podría prolongar sus vidas. “Estamos complacidos con la decisión de la Comisión Europea y esperamos poder ofrecer este nuevo régimen de tratamiento a los pacientes de la Unión Europea”, señaló.
Pembrolizumab ya cuenta con tres indicaciones aprobadas para el cáncer de vejiga, además de otras 28 aprobaciones en la Unión Europea. Anteriormente, fue autorizado como monoterapia para el tratamiento de carcinoma urotelial localmente avanzado o metastásico en adultos que habían recibido quimioterapia con platino o no eran aptos para cisplatino y cuyos tumores expresaban PD-L1 con una puntuación positiva combinada (CPS) ≥10, basado en los estudios Keynote-045 y Keynote-052. En diciembre de 2023, la combinación de pembrolizumab y enfortumab vedotin fue aprobada en Estados Unidos para el tratamiento de cáncer urotelial localmente avanzado o metastásico.
MSD, en colaboración con Pfizer y Astellas, continúa evaluando esta combinación en un amplio programa de desarrollo clínico, que incluye dos ensayos de fase 3 en cáncer de vejiga músculo-invasivo: Keynote-B15 (NCT04700124, también conocido como EV-304) y Keynote-905 (NCT03924895, también conocido como EV-303).