Redacción
Kern Pharma lanza Steqeyma, biosimilar de ustekinumab, y amplia su vademécum para el tratamiento de enfermedades inflamatorias inmunomediadas

El laboratorio farmacéutico Kern Pharma amplía su oferta de anticuerpos monoclonales con el lanzamiento de Steqeyma, biosimilar de ustekinumab, indicado para el tratamiento de la enfermedad de Crohn, psoriasis en placas, psoriasis pediátrica en placas a partir de 6 años y artritis psoriásica. El fármaco está disponible en tres presentaciones diferentes: en forma de solución inyectable en jeringa precargada de 45 mg y 90 mg, por un lado, y en forma de concentrado para solución para perfusión de 130 mg, por otro lado.
Con la incorporación de Steqeyma a su vademécum, Kern Pharma consolida su posición como laboratorio farmacéutico líder y referente en el tratamiento de enfermedades inflamatorias inmunomediadas, categoría en la cual ya dispone de productos como infliximab (Remsima IV) adalimumab alta concentración (Yuflyma) y (Remsina SC), el 1er y único infliximab SC del mercado.
El lanzamiento de este nuevo medicamento es fruto del acuerdo de colaboración que Kern Pharma mantiene, desde hace 9 años, con Celltrion, compañía biotecnológica surcoreana. Con este lanzamiento, Kern Pharma focalizará su actividad comercial en los productos biosimilares en el área de inmunología. A lo largo de 2025, Celltrion gestionará la cartera de productos de onco-hematología que comercializa Kern Pharma en España (Truxima, Herzuma y Vegzelma). Con la incorporación de Steqeyma a su vademécum, Kern Pharma refuerza su compromiso con los pacientes, apostando por formatos innovadores, ofreciendo productos de máxima calidad, y contribuyendo a mejorar la salud y la calidad de vida de las personas. En esta misma línea, cuenta con el portal web Al salir de la consulta donde ofrece a los pacientes de EII consejos para su día a día e información nutricional, sexual, psicológica y sobre la vida laboral.
MSD presenta nuevos datos que refuerzan la vacunación contra el VPH sin distinción de género en adultos

La compañía MSD ha presentado nuevos datos clínicos y en vida real sobre la vacuna contra el virus del papiloma humano (VPH) 9-valente, ‘Gardasil 9’ (vacuna contra el virus del papiloma humano 9-valente, recombinante) que refuerzan la importancia de esta vacunación sin distinción de género en adultos de hasta 45 años.
MSD ha presentado estos datos en el Congreso Internacional sobre el Papilomavirus (IPVC) 2024, que se ha celebrado en Edimburgo (Reino Unido) del 12 al 15 de noviembre. Entre los nuevo datos, figuran los resultados de los estudios Broaden y Progress, que han evaluado la prevalencia de la infección oral por VPH y la carga atribuible a la infección por VPH de los cánceres de orofaringe y otros cánceres de cabeza y cuello.
Además, se han aportado estudios que han evaluado la edad de la infección por VPH causante de enfermedad entre las mujeres y han destacado la importancia de proteger tanto a las mujeres como a los hombres de los cánceres y enfermedades relacionados con el VPH mediante la vacunación.
“Estos datos apoyan el valor de la vacunación en adultos y refuerzan nuestra comprensión de que la infección por VPH causante de enfermedad puede producirse más tarde en la vida, lo que refuerza la importancia de la vacunación contra el VPH tanto en mujeres como en hombres a partir de los 9 años“, ha señalado el vicepresidente senior, jefe de desarrollo clínico global y director médico de MSD Research Laboratories, Eliav Barr.
Otsuka obtiene la exclusividad de un fármaco de Ionis para tratar la ELA causada por mutaciones del gen FUS

La compañía Otsuka Pharmaceutical ha obtenido los derechos exclusivos a nivel mundial para fabricar y comercializar el fármaco ulefnersen (ION363) de la empresa Ionis Pharmaceuticals, que se encuentra en fase de desarrollo clínico para tratar a los pacientes con esclerosis lateral amiotrófica (ELA) causada por la mutación del gen FUS, una enfermedad neurodegenerativa grave que provoca una rápida pérdida del control muscular de las extremidades y parálisis de los músculos respiratorios.
“Otsuka Pharmaceutical está comprometida con el desarrollo global de tratamientos para enfermedades raras como la poliquistosis renal autosómica dominante (ADPKD), la nefropatía por IgA, la nefritis lúpica, el angioedema hereditario (HAE) y la fenilcetonuria (PKU) con el fin de responder a las necesidades médicas no cubiertas. A través de esta nueva colaboración con Ionis Pharmaceuticals, nos esforzaremos por contribuir al tratamiento de pacientes de todo el mundo con ELA causada por mutaciones en el gen FUS“, ha declarado el presidente y consejero delegado de Otsuka, Makoto Inoue.
Otsuka abonará a Ionis un pago inicial de diez millones de dólares (9,5 millones de euros), más pagos por hitos derivados de la consecución de las aprobaciones regulatorias y de los objetivos de ventas, según un comunicado de la compañía, que realizará las solicitudes de autorización a las agencias regulatorias, y se encargará de la fabricación en exclusiva y venta del producto en todo el mundo.
Recta final para probar la eficacia de un fármaco valenciano para tratar la distrofia miotónica tipo 1

La spin-off biotecnológica de la Universitat de València (UV) ARTHEx Biotech ha anunciado la administración del fármaco experimental ATX-01 al primer participante en un ensayo clínico destinado a establecer una opción terapéutica para la distrofia miotónica tipo 1 (DM1), una enfermedad rara, devastadora y sin tratamiento que limita la esperanza de vida y que afecta a más de un millón de personas en el mundo.
Comienza así la recta final de un largo proceso de I+D+i para la aprobación de este nuevo compuesto que habrá de imprimir el sello valenciano en la ciencia del desarrollo de medicamentos para las enfermedades raras, destaca la institución académica en un comunicado.
La distrofia miotónica tipo 1 (DM1), la más frecuente en adultos, es una enfermedad hereditaria y progresiva que afecta principalmente al sistema muscular, aunque también al aparato respiratorio y al sistema nervioso central. Se caracteriza por una reducción de la masa muscular y por la aparición de daños que pueden ser neurológicos, cardiológicos, respiratorios, endocrinológicos o digestivos.
“Si el ensayo tiene éxito, la molécula desarrollada por Arthex podría convertirse en el primer fármaco modificador de la enfermedad para la distrofia miotónica tipo I, la forma más común de distrofia muscular en adultos”, comenta Beatriz Llamusí, directora científica ejecutiva y cofundadora, junto a Rubén Artero, de ARTHEx.
Linerixibat da resultados positivos en su ensayo en pacientes con prurito colestásico
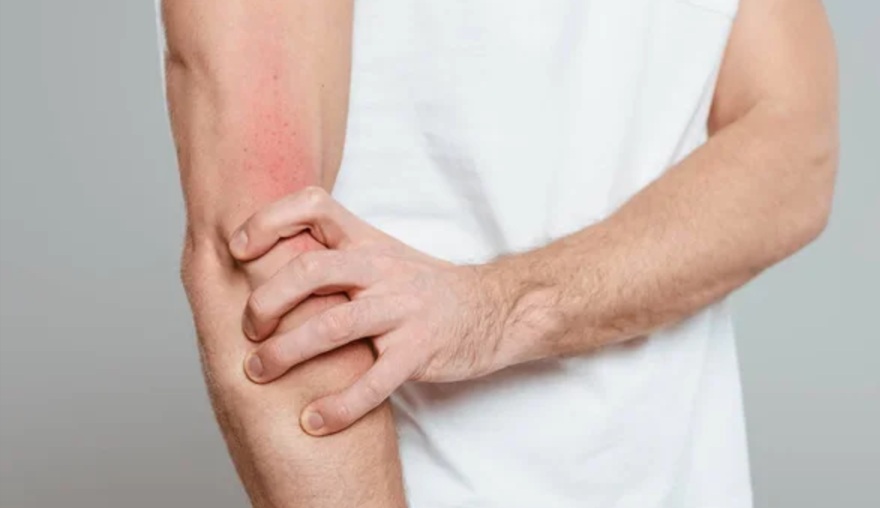
La empresa farmacéutica británica GSK ha anunciado que su tratamiento experimental, linerixibat, logró su objetivo principal en un ensayo clínico de fase avanzada. Esto brinda esperanza a los pacientes que sufren de prurito colestásico, un síntoma debilitante asociado con la colangitis biliar primaria, una enfermedad autoinmune del hígado.
GSK destaca que linerixibat mostró una mejora notable en la reducción del picor en comparación con el placebo, lo que representa un avance significativo en el tratamiento de esta condición, que afecta negativamente la calidad de vida de quienes la padecen. El prurito colestásico, conocido también como “picazón implacable“, es uno de los síntomas más comunes y problemáticos de la colangitis biliar primaria, que en casos severos puede llevar a la insuficiencia hepática.