..Cristina Cebrián.
La Comisión Europea ha autorizado la comercialización del principio activo galcanezumab, comercializado por Lilly bajo la marca Emgality. El fármaco se aprueba como tratamiento preventivo de la migraña en adultos que sufren al menos cuatro días de migraña al mes y su administración se realiza mediante inyección subcutánea una vez al mes. La autorización por parte de la CE es una continuación de la opinión positiva que ya emitió el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) el pasado mes de septiembre.
Galcanezumab es un anticuerpo monoclonal humanizado que se une al péptido relacionado con el gen de la calcitonina, asociado a los episodios de migraña, bloqueando su función
Galcanezumab es un anticuerpo monoclonal humanizado que se une al péptido relacionado con el gen de la calcitonina (CGRP, por sus siglas en inglés), asociado a los episodios de migraña, bloqueando su función. En los tres estudios clínicos de registro que se han realizado, este medicamento logró reducir de forma significativa el promedio mensual de días de migraña (MHD) así como mejorar su funcionalidad en comparación con el placebo.
Enfermedad frecuente e incapacitante
La migraña está considerada como la tercera enfermedad más frecuente y la segunda enfermedad que más incapacidad genera. En España afecta al 12% de la población y más de 4,5 millones de personas padecen migraña de forma ocasional.
Dr. Sacristán (Lilly): “La migraña es una enfermedad que puede llegar a ser incapacitante con opciones de tratamiento limitadas. Esta aprobación supone otro gran hito para galcanezumab”
 Se trata de una enfermedad neurológica caracterizada por episodios recurrentes de dolor de cabeza graves que duran entre 4 y 72 horas, acompañados de otros síntomas entre los que se incluyen náuseas, vómitos, hipersensibilidad a la luz y al sonido y síntomas neurológicos auto limitados que reciben el nombre de aura. Se considera migraña episódica cuando las personas experimentan hasta 14 días con migraña al mes, mientras que se considera migraña crónica cuando se padecen 15 o más días con cefalea al mes de los cuales al menos 8 son de características migrañosas 4 .
Se trata de una enfermedad neurológica caracterizada por episodios recurrentes de dolor de cabeza graves que duran entre 4 y 72 horas, acompañados de otros síntomas entre los que se incluyen náuseas, vómitos, hipersensibilidad a la luz y al sonido y síntomas neurológicos auto limitados que reciben el nombre de aura. Se considera migraña episódica cuando las personas experimentan hasta 14 días con migraña al mes, mientras que se considera migraña crónica cuando se padecen 15 o más días con cefalea al mes de los cuales al menos 8 son de características migrañosas 4 .
“La migraña es una enfermedad que puede llegar a ser incapacitante con opciones de tratamiento limitadas. Esta aprobación supone otro gran hito para galcanezumab y ofrece la posibilidad de reducir el impacto de la migraña en los pacientes que la padecen y mejorar su calidad de vida”, explicó el doctor José Antonio Sacristán, director médico de Lilly en España.
Tres estudios alcanzaron el objetivo primario de determinar si este tratamiento podía conseguir un cambio significativo en el promedio mensual de días de migraña al compararlo con placebo
Estudios EVOLVE y REGAIN
La autorización de comercialización de este fármaco se basa en los datos obtenidos de los estudios EVOLVE-1 y EVOLVE-2, dos ensayos clínicos en fase 3 controlados con placebo, de seis meses de comparación doble ciego cada uno, en pacientes con migraña episódica; y el estudio REGAIN, un ensayo de tres meses doble ciego controlado con placebo en pacientes con migraña crónica.
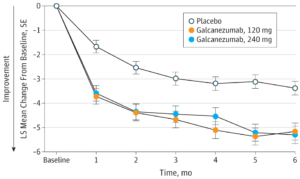
 El objetivo primario de cada ensayo fue determinar si este tratamiento podía conseguir un cambio significativo en el promedio mensual de días de migraña al compararlo con placebo. Los tres estudios alcanzaron el objetivo primario, de forma que los pacientes en tratamiento con galcanezumab lograron una reducción significativa en el promedio mensual de días de migraña durante el primer mes y cada uno de los siguientes meses durante el periodo de tratamiento doble ciego comparado con placebo.
El objetivo primario de cada ensayo fue determinar si este tratamiento podía conseguir un cambio significativo en el promedio mensual de días de migraña al compararlo con placebo. Los tres estudios alcanzaron el objetivo primario, de forma que los pacientes en tratamiento con galcanezumab lograron una reducción significativa en el promedio mensual de días de migraña durante el primer mes y cada uno de los siguientes meses durante el periodo de tratamiento doble ciego comparado con placebo.
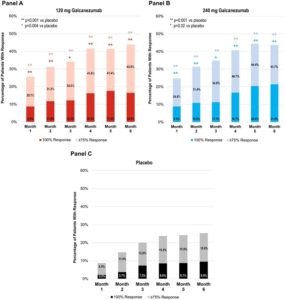
El 15,6% de pacientes logró estar libre de días de migraña al mes de media, comparado con el 6,2% de pacientes tratados con placebo
En estos estudios, más de un tercio de los pacientes lograron, en promedio, reducir al menos un 75% el número de días mensuales de migraña en cualquier mes comparado con el 19,3% y el 17,8% de pacientes tratados con placebo en EVOLVE-1 y EVOLVE-2 respectivamente. Uno de cada siete pacientes (15,6%) logró estar libre de días de migraña al mes, en cualquier mes, en EVOLVE-1, de media comparado con el 6,2% de pacientes tratados con placebo.












