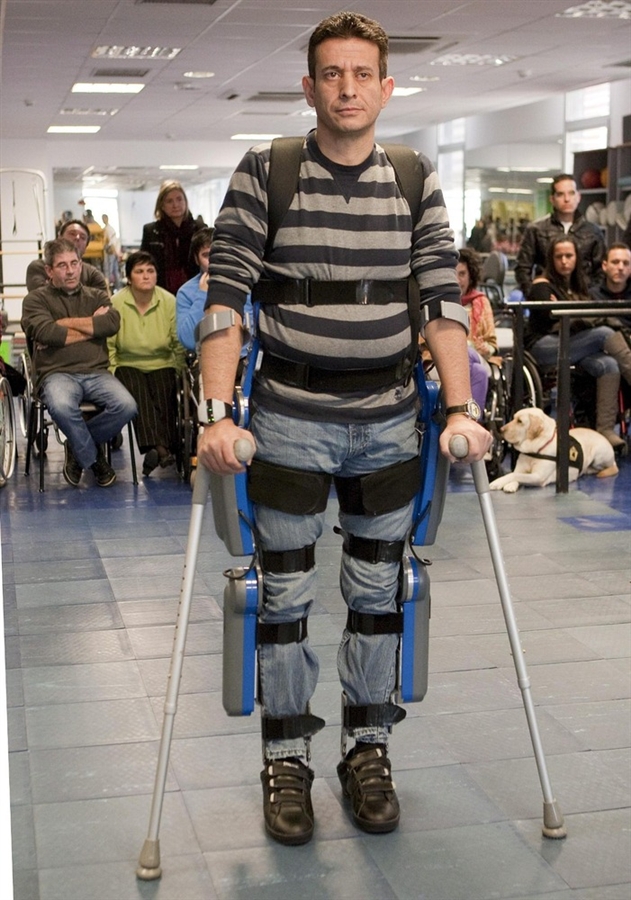
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) ha autorizado la comercialización del primer exoesqueleto (esqueleto externo) que permite andar a las personas con paraplejia. Y es que según informa en un comunicado la FDA, ReWalk es un aparato motorizado que se coloca sobre las piernas y el torso, y permite a una persona que padece lesión de médula espinal poder sentarse, pararse y caminar con la ayuda de unas muletas y la asistencia de otra persona.
En palabras del director de la Oficina de Evaluación de Dispositivos de la FDA, Christy Foreman, “los dispositivos innovadores como ReWalk permiten recorrer un largo camino con la ayuda de muletas para que las personas con lesiones de médula espinal ganen movilidad”, además, “junto con la terapia física, la capacitación y la asistencia de un cuidador, estas personas pueden utilizar estos dispositivos para caminar de nuevo”.
ReWalk se presenta en el mercado como un aparato de metal ajustable que se apoya en las piernas y en el torso. Dispone de unos motores que permiten el movimiento tanto en las caderas, como en las rodillas y tobillos, además de un sensor de inclinación y una mochila que contiene el equipo y la fuente de alimentación. Con el uso de un mando a distancia inalámbrico que se lleva en la muñeca, el usuario manda a ReWalk ponerse de pie, sentarse o caminar. Unas muletas proporcionan al usuario una mayor estabilidad al caminar, pararse y levantarse de una silla.
El dispositivo no está diseñado para los deportes o para subir escaleras, por lo que es importante que tanto los pacientes como sus cuidadores reciban una información amplia por el fabricante para aprender el manejo apropiado del dispositivo.
La FDA ha realizado un estudio sobre el dispositivo a 30 pacientes, detectándose riesgos asociados al aparato como úlceras por presión, moratones o abrasiones, caídas y lesiones e hipertensión diastólica durante su uso. Por ello, la FDA ha solicitado al fabricante, Argo Medical Technologies Inc., que complete el estudio clínico tras la comercialización con un registro en el que recopile datos sobre sus efectos secundarios relacionados con el uso del dispositivo.
..Emilio Ramirez