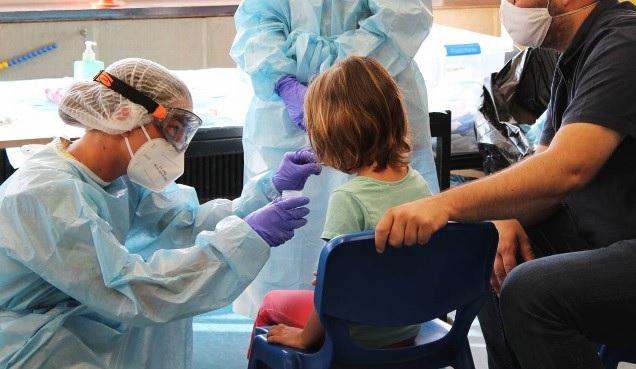
..Gema Maldonado.
La compañía Pfizer considera que hacia el mes de noviembre tendrá los resultados del ensayo de su vacuna frente al Covid-19 en niños de entre seis meses y cinco años para solicitar a la Administración de Medicamentos y Alimentos (FDA, por sus siglas en inglés) su Autorización de Uso de Emergencia (EUA). Un mes antes, entre finales de septiembre y principios de octubre, Pfizer tiene previsto solicitar la autorización para la vacuna dirigida a niños de más de cinco años hasta los 11, cubriendo así a toda la población.
“Esperamos tener datos de seguridad e inmunogenicidad para niños de cinco a 11 años a finales de septiembre y presentar la solicitud a principios de octubre”
Así lo adelantó este martes Albert Boula, CEO de la compañía, durante su participación en Foro Nacional de Investigación en Salud 2021 de Estados Unidos. “Esperamos tener datos de seguridad e inmunogenicidad para niños de cinco a 11 años a finales de septiembre y presentar la solicitud a principios de octubre. De los seis meses a los cinco años de edad esperaríamos presentar datos similares un mes después, asumiendo que todos los datos sean positivos”, apuntó en declaraciones recogidas por medios estadounidenses.
La principal novedad de lo adelantado por Boula está en los plazos que maneja con respecto a la petición de autorización para vacunar a los bebés y niños de hasta cinco años. Hace unos días, en una entrevista con el medio alemán Spiegel, los fundadores de BioNTech ya anunció que los resultados del estudio de su vacuna de ARN mensajero en niños de entre cinco y 11 años ya están listos y son positivos, a falta de su preparación para presentar a las autoridades sanitarias. Solicitarán la autorización en Estados Unidos y “también aquí en Europa”, afirmó Özlem Türeci, cofundadora de BioNTech.
El CEO de Pfizer ha adelantado que esperan “presentar datos similares” de la vacuna en niños de entre seis meses y cincco años “un mes después”
Si todo va como esperan ambas farmacéuticas, antes de final de año podría estar aprobada la vacuna para cubrir a toda la población pediátrica de entre seis meses y 11 años de edad. Es la única franja de edad que no tiene acceso a ninguna de las vacunas de Covid-19 actualmente.
Pero también es la población que menos ha sufrido la enfermedad provocada por el SARS-CoV-2, ya que mayoritariamente pasan la infección de forma leve. La noticia de la posible aprobación de la vacuna para ellos llega con el curso escolar recién iniciado y el inicio de la época en la que comienzan a bajar las temperaturas y suelen volver los virus estacionales que más afectan a bebés y a niños.
Noticias complementarias:
- La EMA da luz verde a la vacuna de Pfizer y BioNTech para niños de 12 a 15 años
- Moderna ya prueba en niños menores de 12 años su vacuna del Covid-19
- La vacuna de Pfizer-BioNTech podría ser aprobada para utilizarse en niños a partir de los 12 años
- Dr. Rafael González de Caldas: “Aumentar la tasa de vacunación es crucial para conseguir la normalidad en el curso escolar”