Redacción
El fármaco tezepelumab (Tezspire), de AstraZeneca, recibido la opinión positiva del Comité de Medicamentos para Uso Humano (CHMP) de la Agencia Europea del Medicamento para su autoadministración en una pluma precargada de un solo uso para pacientes de 12 años o más con asma grave. La decisión del CHMP puede aplicarse sin necesidad de una resolución de la Comisión Europea debido a la naturaleza de la variación Tipo II.
La aprobación para la autoadministración se basa en los resultados del programa de ensayos clínicos Pathfinder, que incluía los resultados del ensayo de fase I Path-Bridge y del ensayo de fase III Path-Home. La mayoría (92%) de profesionales sanitarios, pacientes y cuidadores fueron capaces de administrar con éxito tezepelumab tanto en los centros sanitarios como en los hogares durante todo el ensayo Path-Home. Las mejoras en el control del asma y en el perfil de seguridad observados durante el ensayo coincidieron con los resultados obtenidos en los ensayos clínicos anteriores.
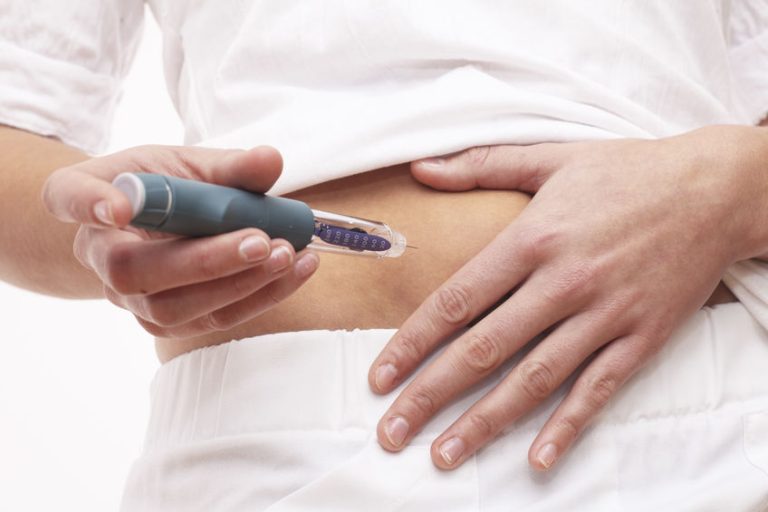
La pluma precargada permite a pacientes y cuidadores la autoadministración del medicamento en casa o en los centros sanitarios mediante un sencillo proceso
Tezepelumab es un medicamento biológico aprobado para el asma grave con independencia de su fenotipo o biomarcadores clave en su ficha técnica aprobada. El profesor Ian Pavord, catedrático de Medicina Respiratoria de la Universidad de Oxford, afirma que “el asma grave sigue teniendo un impacto que debilita la vida de estos pacientes. Creo que la nueva aprobación de la pluma precargada para la autoadministración de tezepelumab será una buena noticia para los médicos y los pacientes de Europa, ya que ofrece un mayor número de opciones y una mayor flexibilidad a la hora de administrar el medicamento”.
En palabras de Mene Pangalos, vicepresidente ejecutivo de I+D de Biofármacos de AstraZeneca: “Tezepelumab es un fármaco aprobado en Europa para pacientes con asma grave con independencia de su fenotipo o biomarcadores clave. Con la nueva aprobación de la pluma precargada para la autoadministración podemos proporcionar a los pacientes en Europa una mayor flexibilidad. Además de ofrecer apoyo a los médicos para el tratamiento de una amplia población de pacientes con asma grave”.
AstraZeneca prevé una decisión reglamentaria de la FDA de EEUU sobre la autoadministración y la nueva pluma precargada en el primer semestre de 2023. Tezepelumab está aprobado actualmente para el tratamiento del asma grave en EEUU, la UE, Japón y otros países.
Tezepelumab está aprobado actualmente para el tratamiento del asma grave en EEUU, la UE, Japón y otros países
De hecho, tezepelumab se encontrará disponible en forma de inyección subcutánea con dosis fija de 210 mg mediante un autoinyector precargado de un solo uso, además de la jeringa precargada de un solo uso. Ambos formatos se administran cada cuatro semanas.
Así, la pluma precargada permite a pacientes y cuidadores la autoadministración del medicamento en casa o en los centros sanitarios mediante un sencillo proceso. El dispositivo se encuentra equipado con un protector de seguridad y una ventanilla de visualización. Asimismo, dispone de clics audibles al principio y al final de la inyección para servir de guía a los pacientes.