P.M.S
El Grupo de Inmunoterapia de la Sociedad Española de Inmunología (SEI) ha elaborado un documento de consenso sobre la monitorización de terapias CAR-T, que resume los principales parámetros a monitorizar antes y después del tratamiento con CAR-T tanto en el paciente como en el producto a infundir.
La monitorización de las terapias biológicas es una herramienta imprescindible para mejorar los resultados en los pacientes, minimizando los posibles efectos adversos y maximizando la efectividad de los tratamientos. En el caso de las terapias celulares, el documento indica que se requiere una monitorización más estrecha, dada su reciente implantación y la limitada experiencia. “El seguimiento de parámetros del sistema inmunitario en las diferentes etapas de la terapia CAR-T permite evaluar desde la idoneidad del paciente para recibir el tratamiento, a la posibilidad de recaídas y efectos adversos, así como el seguimiento de la reconstitución del sistema inmunitario”, explica.
Las terapias celulares requieren una monitorización más estrecha, dada su reciente implantación y la limitada experiencia
Muestra previa a la linfodepleción
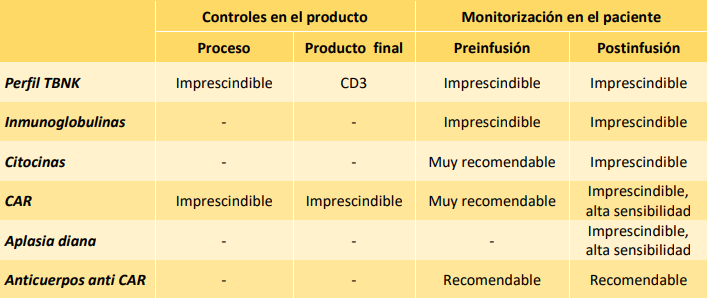
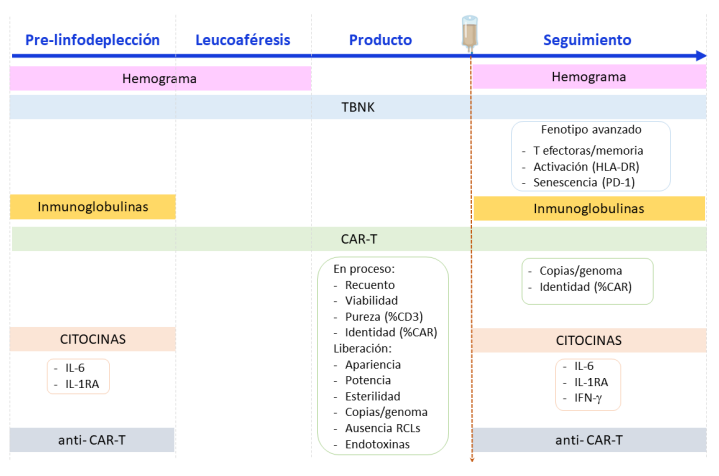
El documento señala que previo a la linfodepleción del paciente es necesario realizar un estudio de inmunoglobulinas y del perfil basal TBNK en sangre periférica: leucocitos (CD45), linfocitos T (CD3, CD4, CD8), linfocitos B (CD19) y células NK (CD16, CD56). Además, apunta que es muy recomendable realizar estudios de citocinas (IL-6, IL-1RA). También señala que es recomendable realizar una tinción para evaluar CAR-T por citometría de flujo, con el objetivo de establecer el umbral de positividad en cada paciente. Asimismo, recomienda evaluar anticuerpos anti-CAR-T para establecer el valor basal en cada paciente.
Leucoaféresis y producto
En la leucoaféresis de partida, hay que determinar el número de leucocitos y linfocitos (por hemograma) y el perfil TBNK. Durante el proceso de producción es importante controlar: recuento, viabilidad, pureza (%CD3) e identidad (%CAR). En el producto final, hay que controlar: recuento, viabilidad, pureza (%CD3) e identidad (%CAR). Se debe verificar la ausencia de virus competentes para la replicación y la ausencia del vector viral. Además, debe determinarse la capacidad citotóxica, mediante co-cultivos con células diana antígeno-positivas, estudiando la fracción de células supervivientes y/o la producción de citocinas. “Hay que garantizar la seguridad y trazabilidad del producto, así como su esterilidad previa infusión al paciente”, añade.
Monitorización post-infusión
Tras la infusión del producto CAR-T, evaluar las poblaciones linfocitarias en sangre periférica, tomando como referencia el perfil pre-infusión del paciente. Como mínimo se debe determinar la distribución T CD4/CD8. Es recomendable un estudio de activación (HLA-DR), senescencia (PD-1) y diferenciación (Memoria/Efectoras) de la población T. Además, es necesaria la monitorización de la población CAR-T mediante citometría de flujo, tomando como referencia la muestra pre-infusión. Adicionalmente, se puede estudiar la expansión mediante qPCR. Esta monitorización se realizará: semanalmente durante el primer mes; cada dos semanas desde el segundo mes hasta el alta; en cada revisión, o al menos a los 3 meses, tras el alta.
Hay que realizar una monitorización de los niveles de citocinas, como mínimo, IL-6 e IL-1RA. Se recomienda también evaluar IFN-gamma, TNF-alfa, IL-10, IL-6 e IL-17A, IL-2, IL-4 e IL-2RA, tomando como referencia el perfil pre-infusión del paciente. La determinación se repetirá semanalmente durante el primer mes, o al menos a los 3 meses (día +100) en ausencia de síndrome de liberación de citocinas (cytokine reléase syndrome, CRS). En caso de presentarse CRS, se realizará al menos una determinación en el momento del diagnóstico y otra una vez resuelto el evento.
Asimismo, es importante la monitorización de la aplasia de la población diana del CAR-T (habitualmente aplasia B), que se podría combinar con estudios de enfermedad mínima residual (EMR) en muestras de sangre periférica en los mismos tiempos y en paralelo a la monitorización de células CAR-T. Por otro lado, es recomendable evaluar la presencia de anticuerpos anti-CAR en el receptor, especialmente si hay sospecha de su aparición por falta de expansión de células CAR-T. Finalmente, el documento de consenso señala que es recomendable hacer los estudios de citometría siguiendo un protocolo de bulk lysis (lisis + tinción) para asegurar el análisis de 3-5 millones de células.