Redacción
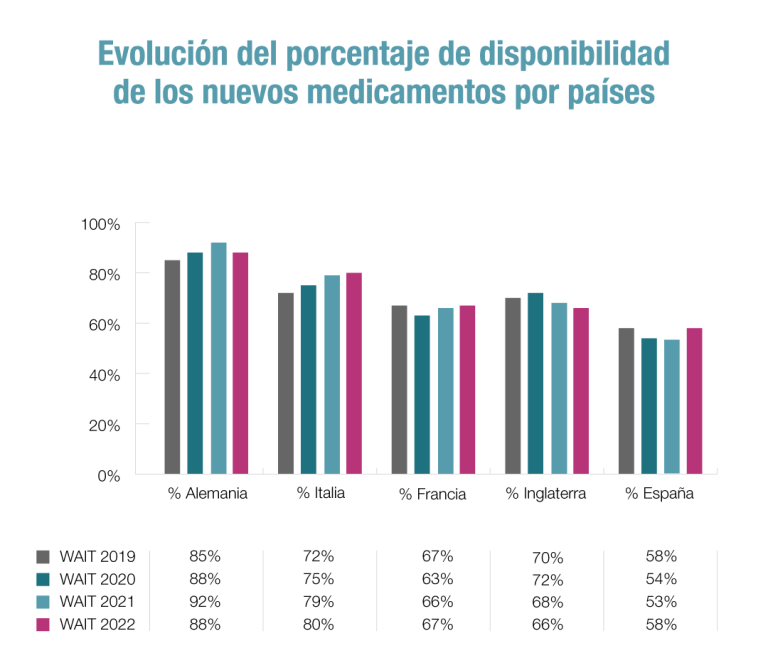
Los nuevos medicamentos son los principales responsables de que las personas vivan más años y con mejor calidad de vida. El problema es que una parte importante de la innovación no está llegando a los pacientes españoles que la necesitan o lo hace con mucho retraso y con restricciones en su uso. España ha mejorado sus cifras al pasar del 53% al 58% en la disponibilidad de nuevos medicamentos aprobados en la Unión Europea (UE). Así, los pacientes españoles pueden acceder a través del Sistema Nacional de Salud (SNS) a 98 de los 168 medicamentos aprobados. No obstante, España sigue lejos de países de referencia como Alemania (88% de disponibilidad), Italia (80%), Francia (67%) e Inglaterra (66%), según refleja el informe anual Indicadores de acceso a terapias innovadoras en Europa 2022 (W.A.I.T. Indicator).
Este trabajo, elaborado por la consultora Iqvia para la Federación Europea de la Industria Farmacéutica (Efpia), analiza el estado de la financiación pública a 1 de enero de 2023 de los medicamentos autorizados entre 2018 y 2021. Por tanto, los pacientes españoles pueden acceder a través del Sistema Nacional de Salud (SNS) a 98 de los 168 medicamentos aprobados.
Se incrementa 112 días el tiempo medio de espera
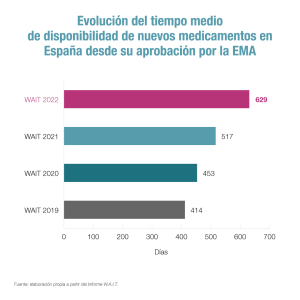 En cuanto al tiempo medio de disponibilidad entre la autorización por la UE y la incorporación al SNS ha aumentado hasta los 629 días, frente a los 517 del año pasado. Desde Farmaindustria indican que esto se debe en buena medida al efecto estadístico que implica que “se han aprobado fármacos que llevaban mucho tiempo esperando su entrada en el mercado”. No obstante, lamentan que este plazo “sobrepasa ampliamente” lo establecido por la legislación (180 días).
En cuanto al tiempo medio de disponibilidad entre la autorización por la UE y la incorporación al SNS ha aumentado hasta los 629 días, frente a los 517 del año pasado. Desde Farmaindustria indican que esto se debe en buena medida al efecto estadístico que implica que “se han aprobado fármacos que llevaban mucho tiempo esperando su entrada en el mercado”. No obstante, lamentan que este plazo “sobrepasa ampliamente” lo establecido por la legislación (180 días).
El tiempo medio de disponibilidad entre la autorización por la UE y la incorporación al SNS ha aumentado 112 días respecto al año pasado
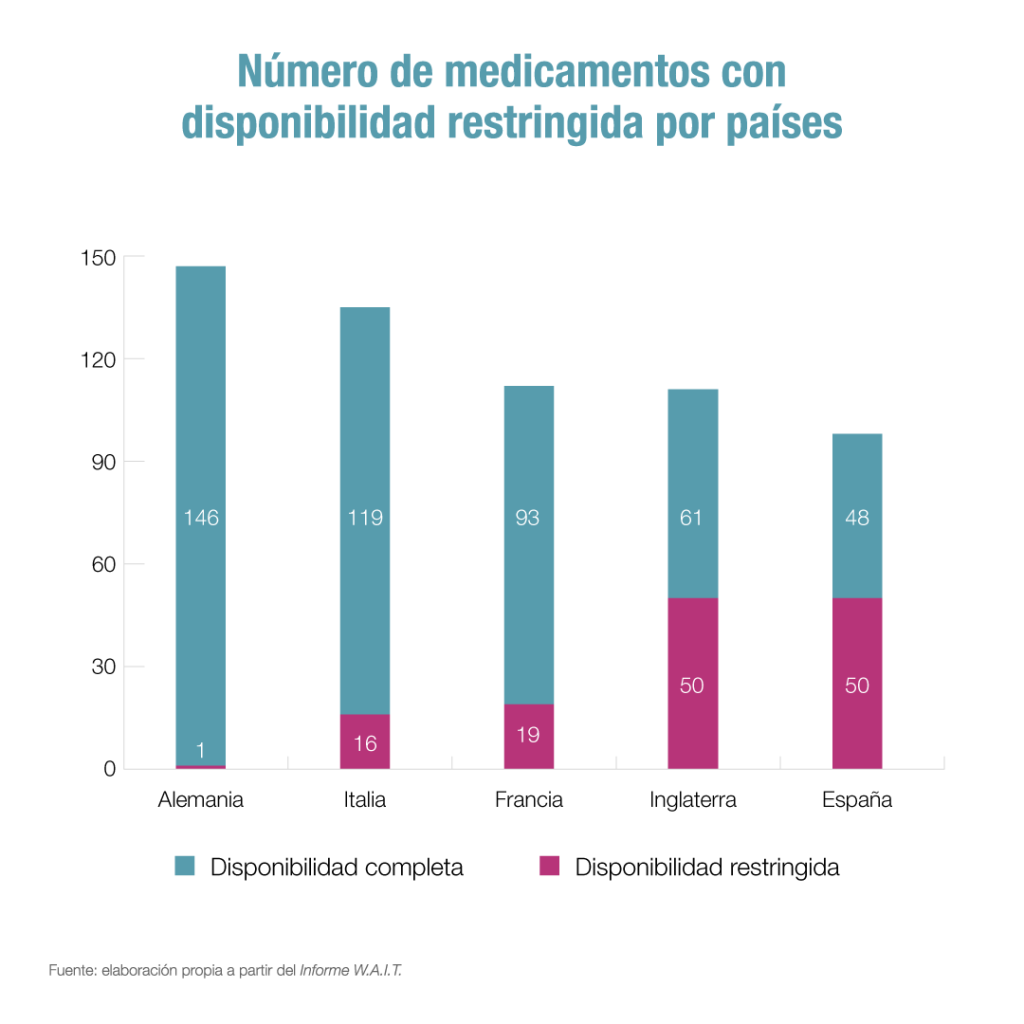 Por otro lado, el informe muestra que la mitad de los nuevos medicamentos disponibles en nuestro país (51%) cuentan con una disponibilidad limitada. En concreto, 50 de los 98 medicamentos financiados en España en el periodo analizado están sometidos a algún tipo de restricción de uso, por indicación terapéutica, tipo de paciente, etc.
Por otro lado, el informe muestra que la mitad de los nuevos medicamentos disponibles en nuestro país (51%) cuentan con una disponibilidad limitada. En concreto, 50 de los 98 medicamentos financiados en España en el periodo analizado están sometidos a algún tipo de restricción de uso, por indicación terapéutica, tipo de paciente, etc.
El porcentaje de medicamentos con restricciones en España está muy por encima de otros países de la UE como Alemania (1%), Italia (12%) y Francia (17%). Además, se ha incrementado en 10 puntos porcentuales en nuestro país desde el informe anterior.
“Este problema de acceso a los medicamentos innovadores es un diagnóstico compartido entre las autoridades sanitarias, pacientes, profesionales sanitarios e industria farmacéutica y requiere una solución urgente en la que desde Farmaindustria ya estamos trabajando con la Administración”, explica Juan Yermo, director general de Farmaindustria.
Juan Yermo (Farmaindustria): “Estamos trabajando con la Administración para solucionar el problema de acceso a la innovación. Se requieren medidas urgentes para mejorar los procedimientos y criterios de financiación”
“Farmaindustria ha propuesto una serie de mejoras en el procedimiento de fijación de precios y financiación pública de medicamentos en nuestro país. El objetivo es establecer un modelo ágil, predecible y eficiente”, recuerda Yermo. “La meta es alcanzable, pero requiere una reforma en profundidad. Es necesario reformular el sistema de precio y financiación; la metodología de evaluación; la función, plazos y estructura de los informes de posicionamiento terapéutico (IPT) que acompañan a los nuevos medicamentos, y los mecanismos de acceso temprano en los fármacos que aporten mayor beneficio clínico a los pacientes”, continúa.
Medicamentos huérfanos y oncológicos
El W.A.I.T. Indicator 2022 revela también cifras de mejora en lo que se refiere a los medicamentos huérfanos. España aumenta el porcentaje de disponibilidad de estos fármacos, pasando de un 44% en el informe de 2021 al 51% en el de 2022. Aun así, la mitad de los nuevos tratamientos tienen un uso restringido y hay 30 huérfanos que no están disponibles en nuestro país, lo que tiene un impacto directo en pacientes con enfermedades raras y sus familias. En Alemania están disponibles el 90%, en Italia, el 82%, y en Francia, el 79%.
“El área de los medicamentos huérfanos es otra en la que debemos poner el foco, sobre todo, teniendo en cuenta que el 40% de los fármacos autorizados en Europa ya son para enfermedades raras y que en muchos casos benefician a pacientes para los que no existe tratamiento alguno”, subraya el director general de Farmaindustria.
El informe también arroja una mejora en la disponibilidad de medicamentos huérfanos en España y un empeoramiento en el caso de los oncológicos
Por el contrario, Farmaindustria lamenta que “España no sale bien en la foto europea en el caso de los tratamientos oncológicos», ya que el informe arroja un porcentaje de disponibilidad del 57% en el periodo 2018-2021 frente al 61% del estudio anterior. El arsenal de novedades oncológicas disponible en Alemania es del 98%, del 83% en Italia, del 76% en Inglaterra y del 72% en Francia.
Los resultados más alentadores del esfuerzo de la industria farmacéutica por dar una respuesta a los pacientes con cáncer y sus familias son, sin duda, las cifras de supervivencia. En las últimas cuatro décadas los años de vida tras el diagnóstico de un tumor se han duplicado, como cifra la Sociedad Española de Oncología Médica (SEOM). La mayoría de los nuevos fármacos oncológicos aprobados por Europa (40 en los últimos tres años) pertenecen ya a la medicina personalizada, que consigue el uso del tratamiento más efectivo en función de las características individuales de cada paciente, a la vez que mejora su perfil de seguridad.
“Los medicamentos, junto con los biomarcadores, deben llegar a los pacientes, para conseguir que este nuevo abordaje frente al cáncer suponga una mejora en la esperanza de vida y logre así dar respuesta a la gran demanda que, por desgracia, implica el cáncer para nuestro sistema sanitario”, sostiene Yermo.
El Plan Estratégico de la Industria Farmacéutica, una oportunidad
Mejorar el acceso de los pacientes a la innovación biomédica, y que además sea rápido y equitativo, es una responsabilidad compartida entre todos los agentes implicados en el proceso, incluyendo las compañías farmacéuticas. “Somos conscientes de la urgencia e importancia de corregir esta situación. Algunos indicadores se están recuperando, pero queda mucho camino para situar el acceso a los medicamentos innovadores a los niveles de nuestros principales socios europeos. Cada día que pasa supone un día más de retraso en tratar a los pacientes”, apunta Yermo.
“Esperamos que las propuestas que hemos puesto en la mesa de discusión sean desarrolladas y queden reflejadas también en el Plan Estratégico de la Industria Farmacéutica, que está preparando el Gobierno con la participación del sector y que se espera para finales del próximo mes de junio. Estamos, por lo tanto, ante un momento clave para desarrollar nuevos procedimientos entre autoridades sanitarias e industria farmacéutica que permitan revertir esta situación”, añade el director general de Farmaindustria.
“Queda mucho camino para situar el acceso a los medicamentos innovadores a los niveles de nuestros principales socios europeos”, señala el director general de Farmaindustria
Revisión de la legislación farmacéutica
Con el objetivo de dar una solución a estas diferencias en la disponibilidad de la innovación, entre otros objetivos, la Comisión Europea (CE) ha publicado esta misma semana la revisión de la legislación farmacéutica, tras veinte años en vigor y en el contexto de la Estrategia Farmacéutica Europea. “La propuesta realizada por las autoridades continentales contiene una serie de medidas que ponen en riesgo el futuro de la industria farmacéutica en Europa y supone una barrera más para el acceso de los pacientes a los tratamientos innovadores», afirman desde Farmaindustria.
En este sentido, desde Farmaindustria se propone que todas las partes interesadas identifiquen y aborden conjuntamente la causa o el origen de las barreras en el acceso a través de medidas efectivas a nivel nacional y “no recurrir a una intervención legislativa europea que, lejos de poner solución a las demoras e inequidades en el acceso en los mercados nacionales, erosiona los incentivos para atraer las inversiones y garantizar que la innovación se genere en Europa».