Gema Maldonado
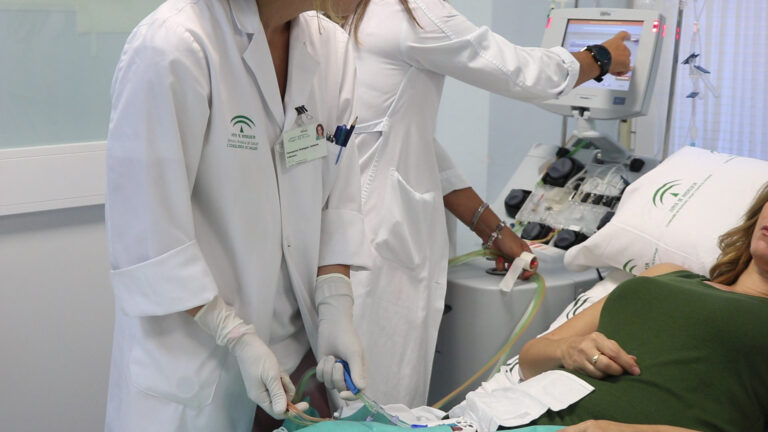
La Comisión Interministerial de Precios de los Medicamentos y Productos Sanitarios (CIPM) ha aprobado la financiación de dos terapias CAR-T nuevas. Se trata de brexucabtagén autoleucel, comercializada por Giliad como Tecartus, para el tratamiento en adultos del linfoma de células del manto, e idecabtagén vicleucel, comercializado por BMS como Abecma, indicado para pacientes adultos con mieloma múltiple. Es la primera aprobación de nuevas terapias CAR-T o nuevas indicaciones en cuatro años y medio.
Una de las terapias con células T propuestas para su financiación es Tecartus, de Giliad, para linfoma de células del manto refractario o en recaída después de dos o más líneas de tratamiento sistémico
La incorporación de esta terapias al SNS es una de las reclamaciones de pacientes y hematólogos en todos los foros sanitarios en los que participan. Terapias que llevan incluso años administrándose en otros países europeos y que a España aún no habían llegado. Especialmente, se han retrasado las CAR-T en las indicaciones de mieloma múltiple y linfoma de células del manto que ahora se verán cubiertas por Abecma y Tecartus, respectivamente.
La decisión positiva sobre ambas terapias se tomó en la última reunión del CIPM, celebrada el pasado 13 de diciembre, en la que se propuesto la financiación de 11 nuevos medicamentos, dos nuevas indicaciones de dos medicamentos ya autorizados para otras indicaciones y un medicamento biosimiliar. Cuatro de los 11 medicamentos que recibieron luz verde de la Comisión tienen la designación de medicamentos huérfanos. Es el caso de las dos terapias CAR-T, cuyas indicaciones aprobadas requieren varias líneas de tratamiento previas.
Abecma se podrá administrar a pacientes con mieloma múltiple en racaída y refractario que han recibido al menos tres tratamientos previos
En el caso de Tecartus, se podrá administrar a pacientes con linfoma de células del manto refractario o en recaída después de dos o más líneas de tratamiento sistémico, incluido un inhibidor de la tirosina-quinasa de Bruto (BTK por sus siglas en inglés). Por su parte, los pacientes que podrán ser candidatos a recibir Abecma, son aquellos con mieloma múltiple en racaída y refractario que han recibido al menos tres tratamientos previos, incluidos un agente inmunomodulador, un inhibidor del proteosoma y un anticuerpo anti -CD38, y han presentado progresión de la enfermedad al último tratamiento.
Tecartus llega a España con un retraso de más de tres años, ya que la Agencia Europea del Medicamento aprobó la terapia para linfoma del manto en octubre de 2020. En septiembre de 2022 recibió la aprobación europea para el tratamiento de pacientes a partir de 26 años con leucemia linfoblástica aguda (LLA) de precursores de células B en recaída o refractaria. Abecma cuenta con luz verde de la EMA desde junio de 2021, fue la primera terapia CAR-T aprobada para mieloma múltiple.
Sanidad propone la financiación de 11 nuevos medicamentos, cuatro de ellos con designación de medicamentos huérfanos, como es el caso de las CAR-T
Las terapia CAR-T y los anticuerpos monoclonales biespecíficos se han posicionado con la gran esperanza en los cánceres hematológicos. España fue pionera en establecer una estrategia de terapias avanzadas en el SNS con medicamentos CAR-T en 2018, lo que situó al país en una posición de liderazgo en Europa. Durante el mandato de Carolina Darias se duplicó el número de hospitales autorizados para administrar CAR-T, hasta alcanzar 25 en adultos y 10 en población pediátrica.
Sin embargo, médicos especialistas en hematología y asociaciones de pacientes han señalado en los últimos meses que el país se había que dado rezagado por la falta de nuevas indicaciones CAR-T. Desde julio de 2019, que se aprobó axicabtagén cilolencel (Yescarta, desarrollada por Gilead) para el tratamiento de pacientes adultos con linfoma B difuso de células grandes en recaída o refractario y linfoma primario mediastínico de células B grandes (LBPM), después de dos o más líneas de tratamiento sistémico, no se había vuelto a aprobar una de estas terapias celulares.
Las nuevas CAR-T llegan a España con un retraso de tres y dos años, respectivamente, desde su aprobación por la EMA
Sin visado para la triple terapia en asma
La última reunión del año del CIMP también aprobó eliminar el visado para la prescripción de la triple terapia para el tratamiento del asma. Para las asociaciones de pacientes asmáticos y los neumólogos y médicos de familia era una “necesidad” que habían reclamado al Ministerio en repetidas ocasiones. Sobre todo desde que el pasado mes de junio Sanidad ya retirara este requisito para la triple terapia en epoc. Los pacientes consideraban un “agravio comparativo” que se mantuviera el visado cuando eran pacientes de asma los que requerían esta terapia.