Redacción
España ha financiado 21 nuevos medicamentos huérfanos autorizados por la Unión Europea (UE) en 2023, 12 más que en el ejercicio anterior, según el Informe Anual de Acceso de los Medicamentos Huérfanos en España de la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (AELMHU).
En 2023, España financió 21 nuevos medicamentos huerfanos, 12 más que el año anterior
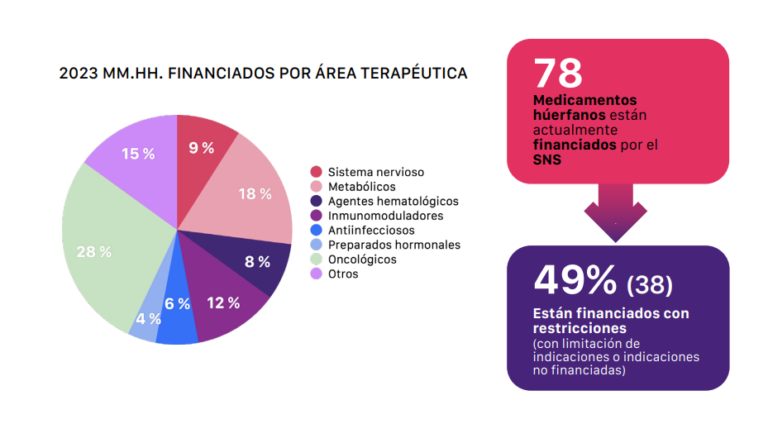
Con este incremento, y respecto a años anteriores, el informe muestra que en 2023 se ha alcanzado la financiación de 78 medicamentos huérfanos, de los 147 que disponen de autorización de comercialización por la Agencia Europea del Medicamento (EMA), es decir, un 53% del total. A pesar de ello, desde AELMHU subrayan que casi la mitad de estos nuevos productos fueron financiados con restricciones.
Además, el 100% obtuvieron un precio condicionado, entre los cuales cinco presentaban condiciones de seguimiento; 12 estaban sometidos a una revisión de ventas y precios; 1 estaba sometido a coste máximo por paciente; y 9 tenían techo de gasto, entre otras condiciones.
El pasado año se alcanzaron los 78 medicamentos huérfanos aprobados, que suponen el 53% de los que tienen la autorización de la EMA. Pero casi la mitad tienen restricciones
El informe, que se han analizado todos los medicamentos huérfanos con nombre comercial, con designación huérfana europea vigente a fecha de 31 de diciembre de 2023, muestra que, por el contrario, todavía hay un total de 45 medicamentos huérfanos que no se financian, correspondientes a áreas terapéuticas como las oncológicas, en un 40%, y las metabólicas, en un 24%. Además, el 49% de estos productos llevan más de 3 años esperando financiación.
Desde AELMHU señalan que los criterios por los que no se les financia son principalmente por cuestiones de racionalización del gasto público en la prestación farmacéutica y por su valor terapéutico, social y beneficio clínico incremental, teniendo en cuenta su relación coste-efectividad. En este sentido, destacan que tampoco se ha aprobado la financiación de ninguna terapia avanzada huérfana, algo que ya pasó en 2022.
Todavía hay un total de 45 medicamentos huérfanos que no se financian, un 40% son para terapias oncológicas y un 24% para las metabólicas
A cierre del informe, España sólo contaba con 123 medicamentos huérfanos con Código Nacional de los 147 que estaban autorizados para su comercialización en la UE. Esto supuso que 24 medicamentos huérfanos autorizados no llegaran al territorio (un 16% de los autorizados), repitiéndose el mismo porcentaje que el año pasado.
Uno de los factores determinantes que podría hacer que la innovación no llegue a los Estados Miembros de la UE, una vez que se obtiene la autorización de comercialización, son los retrasos en los tiempos de financiación que, en 2022, alcanzó una media de espera de tres años.
Sin embargo, el tiempo medio para la financiación en el último año se ha reducido a 23 meses, 11 menos que en 2022. Desde la organización señalan que este dato representa un avance importante con respecto a los retrasos producidos en los últimos años. No obstante, afirman que es necesario continuar con este impulso para poder alcanzar los tiempos de financiación de 2019, cuya media de espera estaba en 14 meses o, incluso, reducirlos.
El tiempo de espera medio para la financiación en España fue de 23 meses el año pasado, 11 meses menos que en 2022
“Durante 2023 y pese a la intensidad electoral, desde AELMHU hemos intensificado el diálogo con las distintas administraciones públicas para sensibilizar sobre la ralentización y el descenso que se produjo en el acceso a los medicamentos huérfanos durante los últimos años. Las mejoras producidas tanto en financiación como en tiempos de espera durante este último ejercicio han supuesto un cambio significativo“, ha subrayado la presidenta de AELMHU, María José Sánchez Losada.
Desde la Asociación destacan el esfuerzo conjunto de todos los actores en estos cambios, liderados por el Ministerio de Sanidad, refuerzan el compromiso de la organización en “seguir trabajando y aportando recomendaciones sobre evaluación, acceso y financiación de medicamentos huérfanos con los agentes implicados en la mejora de la calidad de vida de los pacientes con enfermedades raras”, concluye la presidenta.