Redacción
Muchos medicamentos contra el cáncer aprobados por la Agencia Europea de Medicamentos (EMA) entre 1995 y 2020 carecen de pruebas de beneficio adicional, en particular los aprobados a través de vías aceleradas (“vía rápida”), según un estudio publicado por The British Medical Journal, que recoge Europa Press.
Además, según este trabajo, aunque la industria farmacéutica afirma que se necesitan precios elevados para los medicamentos para compensar los costos de investigación y desarrollo (I+D), los resultados muestran que más de la mitad de estos medicamentos, incluidos aquellos con un beneficio añadido mínimo o nulo, recuperan los gastos de I+D en tres años.
El trabajo investiga los medicamentos contra el cáncer aprobados por la EMA entre 1995 y 2020
Ante estos hallazgos, los investigadores piden una mejor alineación entre los procesos regulatorios y de reembolso, particularmente para los medicamentos aprobados a través de vías aceleradas, para promover el desarrollo de los medicamentos más efectivos para los pacientes con mayores necesidades.
Metodología de análisis
En concreto, investigadores con sede en los Países Bajos utilizaron calificaciones de cuatro agencias de evaluación de tecnologías sanitarias, dos sociedades de oncología médica y un boletín de medicamentos para evaluar el beneficio adicional de los medicamentos oncológicos aprobados por la EMA entre 1995 y 2020.
Analizaron las diferencias entre beneficios añadidos y los ingresos a través de varías vías de aprobación, incluyendo la vía rápida, de la EMA
También compararon los ingresos mundiales por medicamentos procedentes de informes financieros disponibles públicamente de las empresas farmacéuticas con estimaciones de gastos en I+D publicadas anteriormente.
Se analizaron las diferencias en los beneficios añadidos y/o los ingresos a través de varias vías de aprobación de la EMA: autorización de comercialización estándar (SMA), autorización de comercialización condicional (CMA) y autorización en circunstancias excepcionales (AEC).
El 23% de las calificaciones de beneficios anadidos identificadas, tenía beneficio menor y el 41% beneficio añadido negativo o no cuantificable
De las 458 calificaciones de beneficios añadidos identificadas, 59 (13%) se clasificaron como beneficio añadido importante, 107 (23%) como beneficio añadido sustancial, 103 (23%) como beneficio añadido menor y 189 (41%) como beneficio añadido negativo o no beneficio añadido cuantificable.
En comparación con los medicamentos aprobados según la vía estándar (SMA), tanto los CMA solos como en combinación con AEC tenían más probabilidades de recibir una calificación de beneficio adicional negativa o no cuantificable.
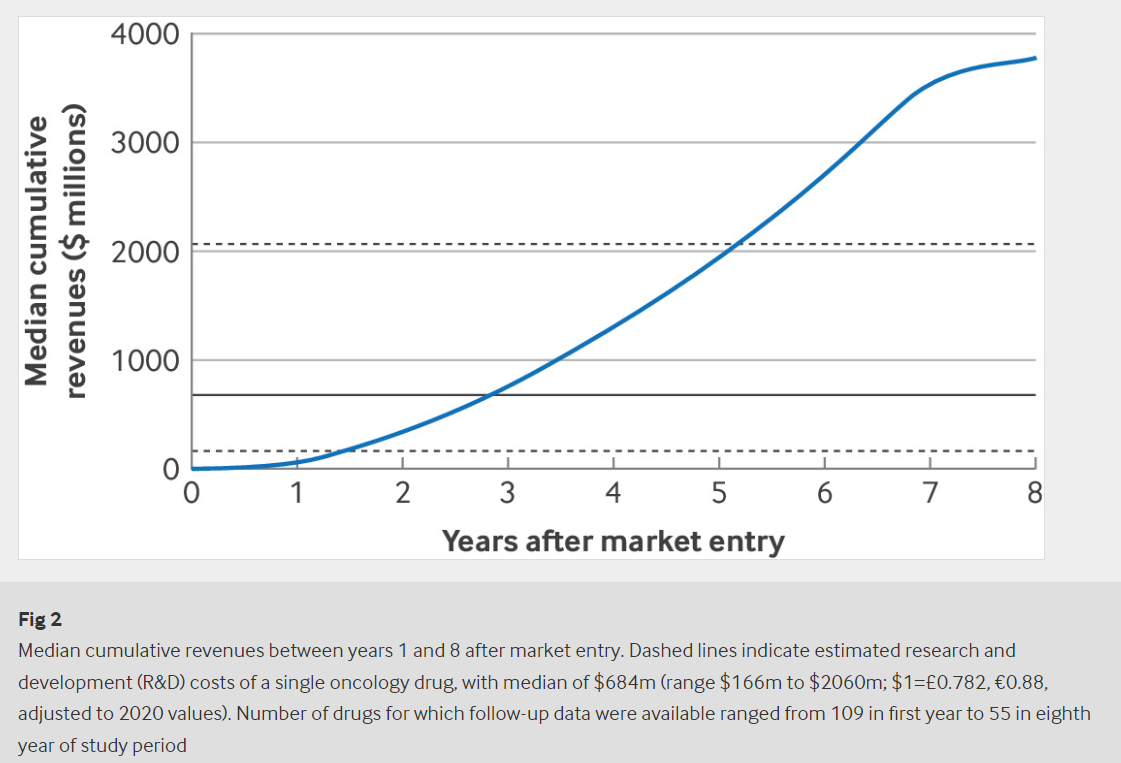
Más de la mitad de estos medicamentos, incluso los que carecían de pruebas de beneficios adicionales, recuperaron el coste medio de I+D de 684 millones de dólares en tres años
Los ingresos por medicamentos generalmente aumentaron en línea con el beneficio adicional y, aunque los CMA generaron menores ingresos y tardaron más en compensar los gastos de I+D que los SMA, más de la mitad de estos medicamentos, incluso aquellos que carecían de pruebas de beneficios adicionales, lograron recuperar los costos medios de I+D de 684 millones de dólares en un plazo de hasta tres años.
Casi todos (91%) de los medicamentos incluidos habían recuperado los costos de I+D en ocho años. Estos son hallazgos observacionales y los investigadores señalan limitaciones, como no considerar el tamaño de la población de pacientes o el efecto potencial de los medicamentos utilizados para más de una indicación, y utilizar estimaciones generalizadas de los costos de I+D.