Redacción
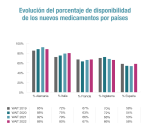
Entre 2019 y 2022 la Agencia Europea del Medicamento dio luz verde a 167 fármacos nuevos pero, de ellos España tenía incorporados en la financiación pública en enero de 2024 un total de 103, el 62% de los autorizados, y se acumulan 22 meses de retraso, es decir, 661 días, un plazo mayor que en el informe anterior, de 629 días, según lo refleja el informe de Indicadores de acceso a terapias innovadoras en Europa 2023, elaborado por la consultora Iqvia para la Federación Europea de la Industria Farmacéutica (Efpia), hecho público este miércoles.
La situación del acceso a medicamentos innovadores muestra una mejora en la tendencia en los últimos dos años, aunque sigue siendo un desafío para España
La situación muestra una mejora en la tendencia en los últimos dos años. De hecho, España es uno de los grandes países europeos que ha mejorado esta ratio (nueve puntos porcentuales en los dos últimos años), a diferencia de lo ocurrido en Alemania, Francia, Italia o Reino Unido. En todo caso el acceso a los nuevos fármacos sigue siendo un desafío para España, ya que, a pesar de esta mejora, aún se encuentra por detrás de estos países.
“Aumentar el número de medicamentos disponibles y reducir los retrasos en su incorporación en el SNS es uno de los grandes pilares del Plan Estratégico de la Industria Farmacéutica que estamos ultimando junto al Gobierno“, afirma el director general de Farmaindustria, Juan Yermo.
Este plan, en el que Farmaindustria lleva meses trabajando junto a la Administración, es un proyecto país que, recuerda Yermo, “plantea un proyecto ambicioso y realista para que España se convierta en unos años en uno de los pocos hubs mundiales de innovación biomédica, investigación clínica y preclínica de vanguardia, producción de medicamentos (incluyendo biológicos y terapias avanzadas) y cuyo objetivo final es mejorar y acelerar la llegada de los nuevos medicamentos a todos los pacientes que los necesiten y cuando los necesiten”.
En el aumento de días de espera hasta acceder a medicamentos innovadores en España influye que algunos medicamentos aprobados habían sido previamente rechazados y su aprobación es fruto de un segundo o tercer intento
El informe refleja que no llegan todos los medicamentos y que los pacientes españoles cada vez esperan más su llegada. Según el informe, el tiempo medio de demora alcanza ya los 22 meses desde la autorización europea. Este plazo, de 661 días, es mayor que en el informe anterior, de 629 días. En este aumento influye, no obstante, un efecto estadístico porque algunos de ellos son medicamentos para los que se decidió inicialmente su no financiación y por tanto ahora son resultado de un segundo o incluso un tercer intento de inclusión.
Si en lugar de tener en cuenta la fecha de la autorización europea (que es única y que por eso utiliza el informe W.A.I.T para permitir la comparación entre todos los países europeos) se contabiliza el tiempo a partir del momento en el que la compañía manifiesta su interés en comercializar en España (obtención del código nacional), el tiempo se reduce hasta los 551 días. Un plazo que también supera con creces los 180 días establecidos en la legislación europea y nacional.
El periodo medio hasta la comunicación de la solicitud de comercialización de las compañías es de 100 días, aunque en el caso de las compañías asociadas a Farmaindustria el intervalo es menor, de una media de 75 días. El informe también revela que en más de la mitad de los fármacos (52%) que se financian se incluyen restricciones en cuanto a las indicaciones para las que pueden prescribirse. Un porcentaje que también ha aumentado en los últimos dos años.
El periodo medio hasta la comunicación de la solicitud de comercialización de las compañías es de 100 días
Mientras se decide la financiación de los medicamentos por parte del Ministerio de Sanidad, la única opción de los pacientes para acceder a ellos es mediante solicitud individualizada, conforme se indica en el Real Decreto por el que se regula la disponibilidad de medicamentos en situaciones especiales. En la actualidad no existe un acceso precoz para grupos de pacientes definidos, como en otros países, ni la posibilidad de acortar el tiempo de disponibilidad.
En el ámbito europeo, el informe refleja que, de media, los pacientes europeos esperan una media de 531 días a la llegada de nuevos medicamentos a su país, 14 días más que en el estudio anterior. La disponibilidad de medicamentos es de un 43% de media, una cifra ligeramente menor a la del informe previo.
El estudio revela además grandes diferencias entre los países, que llega a ser del 84% entre el país con mayor disponibilidad (Alemania, con un 88%) y con menor acceso (Malta, con un 4%).
En el ámbito europeo, el informe refleja que, de media, los pacientes europeos esperan una media de 531 días
Con el objetivo de acelerar la llegada de los medicamentos en situaciones donde el beneficio es más relevante —por gravedad o en caso de enfermedades sin alternativa terapéutica—, Farmaindustria ha presentado una Propuesta para el acceso temprano a los medicamentos innovadores.
El documento plantea, sin necesidad de un cambio normativo, un procedimiento que permita una decisión de financiación acelerada en un plazo máximo de 90 días para todos los pacientes, en condiciones de equidad, de los fármacos que (seleccionados por la administración) cumplan ciertos criterios que hagan más urgente su financiación. De esta manera se evitarían buena parte de las solicitudes individualizadas en situaciones especiales.
“Necesitamos garantizar que todos los pacientes reciban en condiciones de equidad el mejor tratamiento posible, y en ocasiones eso no es posible con la dinámica actual. Proponemos que se establezcan criterios y un sistema claro y predecible que mejore la disponibilidad de los nuevos tratamientos cuando más se necesitan”, afirma Yermo.