Redacción
Investigadores de la Universidad de Massachusetts Amherst y de la Escuela de Medicina Chan de la Universidad de Massachusetts han demostrado en ratones la eficacia de un nuevo tratamiento para reducir y eliminar el cáncer de páncreas. Ocho de los nueve ratones evaluados experimentaron mejoras en los tumores, incluidos dos en los que los tumores desaparecieron por completo. El estudio, publicado en Science Translational Medicine, describe los efectos sinérgicos de un nuevo sistema de administración de fármacos a partir de nanopartículas para activar una vía inmunitaria en combinación con agentes dirigidos a los tumores.
La administración de nanopartículas de agonistas inmunes innatos combinada con agentes inductores de senescencia promueve el control de las células T en el cáncer de páncreas
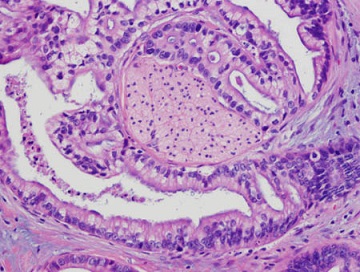
El adenocarcinoma ductal pancreático (PDAC) es la forma más común de cáncer de páncreas, con una tasa de supervivencia a cinco años de solo el 13%. “El cáncer de páncreas, lamentablemente, no responde a la mayoría de las terapias convencionales, como la quimioterapia o incluso la inmunoterapia, que ha revolucionado muchas terapias contra el cáncer en los últimos 10 años”, indica Marcus Ruscetti, profesor asistente de biología molecular, celular y del cáncer en la Facultad de Medicina Chan de UMass y autor correspondiente del artículo.
En este sentido, Prabhani Atukorale, profesora adjunta de ingeniería biomédica en UMass Amherst y otra de las autoras correspondientes del artículo, explica que “la administración de fármacos es un gran desafío debido a la arquitectura del microambiente de estos tumores difíciles de tratar”. Además, señala que el entorno bloquea la activación de las células inmunitarias del cuerpo y su penetración en el tumor.
La encapsulación de nanopartículas facilita la administración segura y eficaz de agonistas de Sting y TLR4 al microambiente tumoral de PDAC
Las investigaciones anteriores de Ruscetti demostraron que dos fármacos contra el cáncer (el inhibidor de MEK trametinib y el inhibidor de CDK4/6 palbociclib o T/P) pueden promover el desarrollo de los vasos sanguíneos, lo que permite una mayor llegada de células T (así como de quimioterapia) al tumor. Sin embargo, el cáncer “engaña” al sistema inmunológico para que piense que el tumor es simplemente un grupo normal y sano de células. Dado que las células T no están activadas, el simple hecho de tener más de ellas presentes no eliminará el cáncer.
En este punto, los investigadores apostaron por la vía estimuladora de genes de interferón (Sting, por sus siglas en inglés), que reconoce las infecciones virales en el cuerpo. “Si podemos engañar al sistema inmunológico para que piense que hay una infección de tipo viral, aprovechamos una respuesta inmunitaria antitumoral muy sólida para aplicar inmunoterapia contra los tumores”, explica Atukorale.
Los investigadores también querían activar la vía TRL4 porque potencia los efectos de la activación de Sting. Utilizan agonistas en vías de estimulación inmunitaria, pero conseguir que estas sustancias químicas desencadenantes de la inmunidad atraviesen el microambiente del tumor sigue siendo un desafío. La solución de los investigadores es encapsular los agonistas de STING y TRL4 en un nuevo diseño de nanopartículas basadas en lípidos.
Las nanopartículas tienen varias ventajas. En primer lugar, la investigación demostró que son muy eficaces para introducir los agonistas en el complicado microambiente tumoral. El diseño también permite que ambos agonistas se empaquen juntos. Esto garantiza que se transporten juntos dentro de la circulación sanguínea, lleguen juntos a la misma célula diana y sean absorbidos juntos por la misma célula diana.
Las nanopartículas son muy eficaces para introducir los agonistas en el complicado microambiente tumoral
“Estamos utilizando materiales biocompatibles basados en lípidos para encapsular medicamentos que funcionan juntos funcionalmente, pero que no les gusta estar uno al lado del otro, y luego podemos usar capacidades de ingeniería para incorporar varias funcionalidades para dirigirlos a donde necesitan ir”, detalla.
El efecto sinérgico de los dos agonistas más la terapia T/P resultó eficaz: ocho de los nueve ratones experimentaron necrosis y reducción del tumor. “Tuvimos dos ratones que tuvieron respuestas completas, lo cual es bastante sorprendente. Nunca habíamos visto eso en este modelo antes”, asegura Ruscetti. Sin embargo, señala que queda trabajo por hacer ya que los tumores regresaron después de que los ratones suspendieran el tratamiento. En cualquier caso, resalta que “sigue siendo un paso muy alentador hacia la cura”.
“Si se va más allá del cáncer de páncreas y se abordan otros tipos de cáncer, se necesita una terapia combinada que ataque al tumor y al sistema inmunológico. Esta es una estrategia para poder hacerlo”, asevera. Los tratamientos para cánceres como el PDAC que podrían derivarse de este estudio incluyen mutaciones del cáncer de colon, cáncer de pulmón, cáncer de hígado y colangiocarcinoma (cáncer de los conductos biliares).