..Redacción.
El estudio KarMMa en fase 2 presenta resultados positivos sobre la evaluación de la eficacia y la seguridad del uso de la terapia CAR-T ide-cel dirigida al BCMA en pacientes adultos con mieloma múltiple en recaída y refractario. Así lo anunciaron las empresas responsables del estudio, Celgene y bluebird bio, en el Congreso anual de la Sociedad Americana de Hematología (ASH) 2019, celebrado en Orlando (Florida, EE.UU.) del 7 al 10 de diciembre.
Según indican sus responsables, el ensayo ha demostrado respuestas profundas y duraderas en una población de pacientes con mieloma múltiple muy tratados previamente. En el estudio participaron 140 pacientes, de los cuales 128 fueron tratados con ide‑cel en un rango de dosis objetivo de entre 150 y 450 x 10 elevado a 6 células CAR-T después de recibir quimioterapia linfodeplectiva.
El ensayo ha demostrado respuestas profundas y duraderas en una población de pacientes con mieloma múltiple muy tratados previamente
Todos los pacientes habían recibido al menos tres tratamientos previos. Se trataron con un fármaco IMiD, un IP y un anticuerpo anti-CD38. Y todos habían sido refractarios a su último tratamiento: su enfermedad había progresado mientras estaban en su último tratamiento o en los 60 días siguientes a haberlo recibido.
La terapia ide-cel que se ha aplicado es una CAR-T dirigida contra el antígeno de maduración de células B (BCMA). Este se expresa en la superficie de las células plasmáticas normales y malignas. El mecanismo de acción propuesto de las células T CAR de Ide-cel es el reconocimiento y la unión al BCMA en la superficie de las células de mieloma múltiple para provocar su apoptosis.
La terapia ide-cel que se ha aplicado es una CAR-T dirigida contra el antígeno de maduración de células B (BCMA)
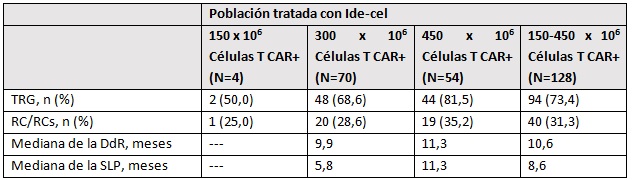
Los resultados obtenidos tras 11,3 meses de media de seguimiento de estos pacientes, indican una tasa de respuesta global del 73% y de respuesta completa del 32%. La duración de la respuesta en los 128 pacientes tratados con ide-cel fue de 10,6% y la supervivencia libre de progresión de la enfermedad alcanzó una media 8,6 meses. Son datos del total de pacientes tratados, que incluyen desde 150 a 450 x 10 elevado a 6 células CAR-T. Si nos centramos en los pacientes que recibieron la máxima dosis, tanto la duración de la respuesta como la supervivencia libre de progresión de la enfermedad se sitúa en los 11,3 meses.
“Los resultados del estudio KarMMa constituyen otra prueba más de que ide‑cel es una posible opción terapéutica para esta población de pacientes muy tratados previamente. Estamos animados por estos datos, especialmente por los resultados observados con la dosis objetivo más alta de 450 x 106 células T CAR+”, explicó la Dra. Kristen Hege, vicepresidenta senior de hematología/oncología y terapia celular de la división de desarrollo clínico inicial de Bristol Myers-Squibb.
Dra. Kristen Hege: “Estamos animados por estos datos, especialmente por los resultados observados con la dosis objetivo más alta de 450 x 106 células T CAR+”
La doctora anunció que se están preparando “para presentar estos datos a las autoridades sanitarias. El fin es conseguir la aprobación inicial de ide‑cel como la primera terapia de células CAR-T dirigida al BCMA”.
Según indicaron las compañías, los resultados de seguridad del estudio fueron coherentes con los observados en el estudio fase 1 CRB‑401. En é se evaluó la seguridad y la eficacia preliminares de ide‑cel. El 5,5% (7/128) de los pacientes presentaron episodios de síndrome de liberación de citocinas (SLC) de grado 3 o superior. Un paciente murió a causa de un SLC.
En los pacientes que recibieron la máxima dosis, tanto la duración de la respuesta como la supervivencia libre de progresión de la enfermedad se sitúa en los 11,3 meses
Según los investigadores, el 3,1% (4/128) de los pacientes presentaron episodios de neurotoxicidad (NT) de grado 3 o superior. Pero no hubo ningún episodio de NT de grado 4. Menos del 6% de los pacientes de cada grupo de dosis investigado presentaron episodios de SLC y NT de grado 3 o superior. El 83,6% (107/128) de los pacientes presentaron SLC de cualquier grado y el 18% (23/128) de los pacientes presentaron NT de cualquier grado.
“Teniendo en cuenta estos datos, bluebird bio y Celgene seguirán desarrollando ide‑cel tan rápido como sea posible para los pacientes con mieloma de fase tardía”, dijo la Dra. Joanne Smith-Farrell, directora de la división de oncología y directora comercial de bluebird bio. Además, añadió que “al mismo tiempo continuarán llevando a cabo su amplio programa de desarrollo para conocer los beneficios potenciales de ide‑cel de fases más tempranas del tratamiento”.