Redacción
La Alianza Daiichi Sankyo–AstraZeneca ha presentado resultados positivos de trastuzumab deruxtecán (T-DXd), de nombre comercial Enhertu, en dos ensayos comparativos de fase 3 en pacientes con cáncer de mama metastásico HER2 positivo. Además, ha presentado dos ensayos con datopotamab deruxtecán (Dato-DXd) en pacientes con cáncer de mama metastásico HER2 negativo con receptores hormonales positivos (RH+) y como monoterapia y en combinación con durvalumab en pacientes con cáncer de mama metastásico triple negativo.
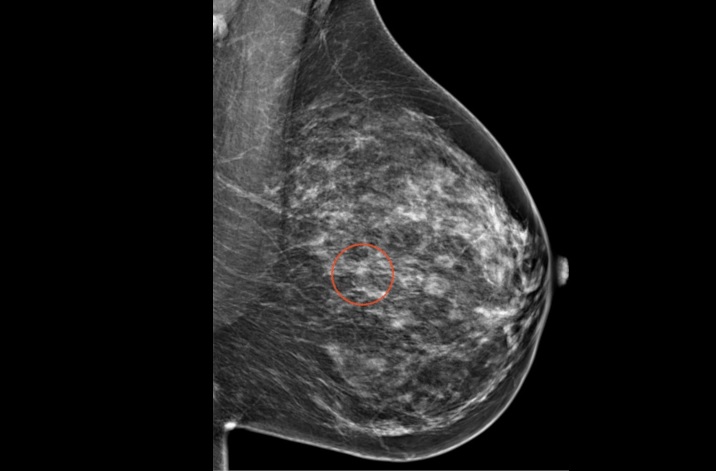
En cáncer de mama metastásico (CMM) HER2 positivo, los ensayos Destiny-Breast02 y Destiny-Breast03 de trastuzumab deruxtecán muestran una mejora estadísticamente significativa de la supervivencia global (SG)
Los resultados se han presentado en el marco del mayor congreso mundial de cáncer de mama, San Antonio Breast Cancer Symposium (#SABCS22), celebrado en San Antonio, Texas (Estados Unidos), entre el 6 y el 10 de diciembre de 2022. Además, los datos se han presentado simultáneamente a la publicación en la revista médica The Lancet de los resultados actualizados de Destiny-Breast03.
Así, los resultados actualizados del ensayo de fase 3 Destiny-Breast03 han puesto de manifiesto que este anticuerpo conjugado (ADC) muestra una mejora estadística y clínicamente significativa en la supervivencia global en comparación con trastuzumab emtansina (T-DM1) en pacientes con cáncer de mama HER2 positivo no resecable y/o metastásico previamente tratado con trastuzumab o un taxano. En este ensayo se demostró una reducción del 36% en el riesgo de muerte frente a T-DM1.
Reduce el riesgo de muerte en un 36%, y muestra una mejora de la mediana de supervivencia libre de progresión (mSLP) de 28,8 meses frente a T-DM1, además de mejoras significativas en SLP y SG frente a la quimioterapia
Todavía no se ha alcanzado la mediana de SG en ninguno de los brazos de tratamiento tras una mediana de duración de seguimiento de 28,4 meses para T-DXd y 26,5 meses para T-DM1. En el brazo de T-DXd, se estima que el 77,4% de los pacientes estaban vivos a los dos años, en comparación con el 69,9% de los pacientes tratados con T-DM1. El beneficio de supervivencia observado fue consistente en todos los subgrupos analizados, incluidos los pacientes con o sin metástasis cerebrales basales, con o sin enfermedad visceral basal, HR+ o HR- independientemente del tratamiento previo con pertuzumab o terapia sistémica.
Resultados preliminares de Destiny-Breast02
Además, en los resultados preliminares del ensayo de fase 3 Destiny-Breast02 este tratamiento demostró una reducción del 64% en el riesgo de progresión de la enfermedad o muerte en pacientes con cáncer de mama HER2 positivo no resecable y/o metastásico previamente tratados con T-DM1 en comparación con el tratamiento de elección del médico (trastuzumab más capecitabina o lapatinib más capecitabina). La mediana de SLP para los pacientes en el brazo de T-DXd fue de 17,8 meses, en comparación con 6,9 meses para el tratamiento de elección, según un comité ciego de revisión central independiente (BICR). Este ADC también mostró una reducción del 34% en el riesgo de muerte en comparación con el tratamiento de elección, con una mediana de SG de 39,2 meses de este ADC, frente a 26,5 meses con el tratamiento de elección.
Los resultados de Destiny-Breast02 confirman los datos observados en el ensayo de fase 2 Destiny-Breast01, que respaldó las primeras aprobaciones de este anticuerpo conjugado de la Alianza Daiichi Sankyo-AstraZeneca en pacientes con cáncer de mama metastásico HER2 positivo que han recibido previamente dos o más regímenes anti-HER2.
En los resultados preliminares del ensayo de fase 3 Destiny-Breast02 este tratamiento demostró una reducción del 64% en el riesgo de progresión de la enfermedad o muerte
“Los beneficios de supervivencia global mostrados en los ensayos Destiny-Breast03 y Destiny-Breast02 validan aún más el papel de este tratamiento y su potencial para alargar la vida de las personas con cáncer de mama metastásico HER2 positivo previamente tratado”. Así lo destacó el Dr. Ken Takeshita, director global de investigación y desarrollo de Daiichi Sankyo. “Además, la mediana de supervivencia libre de progresión fue cuatro veces mayor, con uno de cada cinco pacientes tratados con nuestro anticuerpo conjugado sin signos de enfermedad en comparación con T-DM1 en Destiny-Breast03. Esto es particularmente relevante en el entorno metastásico del cáncer de mama HER2 positivo”.
“Los resultados actualizados de Destiny-Breast03 muestran que nuestro anticuerpo conjugado prolonga la vida de los pacientes y retrasa la progresión de la enfermedad en casi dos años. Esto refuerza nuestra confianza en su potencial de establecer un nuevo estándar de tratamiento en segunda línea para los pacientes con cáncer de mama metastásico HER2 positivo“, señaló Susan Galbraith, vicepresidenta ejecutiva de investigación y desarrollo de oncología de AstraZeneca, “complementado por Destiny-Breast02, ahora tenemos dos ensayos de fase 3 en cáncer de mama metastásico HER2 positivo que muestran que los pacientes tratados con este ADC en los ensayos están libres de enfermedad durante más tiempo y viven más, en comparación con el estándar de tratamiento anterior”.
Susan Galbraith (AstraZeneca): “Tenemos dos ensayos de fase 3 en cáncer de mama metastásico HER2 positivo que muestran que los pacientes tratados con este ADC en los ensayos están libres de enfermedad durante más tiempo y viven más”
Resultados alentadores en CMM HER2 negativo RH positivo
Por su parte, los resultados iniciales del ensayo de fase 1 Tropion-PanTumor01 de datopotamab deruxtecán (Dato-DXd) mostraron una actividad clínica alentadora en pacientes con cáncer de mama HER2 negativo RH positivo no resecable o metastásico muy pretratados. Al igual que el otro fármaco de la Alianza Daiichi Sankyo-AstraZeneca, este anticuerpo conjugado dirigido a TROP2 (inhibidor de la topoisomerasa I) está siendo desarrollado de forma conjunta.
Aproximadamente, el 70% de los pacientes con cáncer de mama se consideran HER2 negativo HR positivo. Actualmente, para las personas con este tipo de cáncer de mama, la quimioterapia es el estándar de tratamiento cuando hay progresión de la enfermedad o el paciente no es apto para terapia hormonal. Hoy en día, no hay terapias dirigidas a TROP2 aprobadas para este subtipo de cáncer de mama.
En CMM HER2 negativo RH positivo, que supone aproximadamente el 70% de los casos de cáncer de mama, el ensayo Tropion-PanTumor01 de datopotamab deruxtecán muestra una actividad clínica alentadora en pacientes muy pretratadas
En el ensayo Tropion-PanTumor01, se observó una tasa de respuesta objetiva (TRO) del 27% en una cohorte de 41 pacientes con CM no resecable o metastásico HER2 negativo HR positivo tratados con este ADC, según BICR. Se observaron 11 respuestas parciales (RP) y 23 casos de enfermedad estable (EE). No se ha alcanzado la mediana de duración de la respuesta (DdR) después de una mediana de seguimiento de 13,7 meses. Además, se observó una tasa de beneficio clínico (TBC) del 44% y una tasa de control de la enfermedad (TCE) del 85%. La mediana de SLP fue de 8,3 meses y la mediana de SG aún no se ha alcanzado con el 59% de los pacientes vivos durante más de un año.
Cáncer de mama triple negativo
Por último, también se presentaron dos ensayos que evaluaron Dato-DXd tanto en pacientes con cáncer de mama metastásico triple negativo (CMTN) en monoterapia (Tropion-PanTumor01), como en combinación con durvalumab (Imfinzi) en primera línea (Begonia).
En monoterapia, los datos actualizados del ensayo de fase 1 Tropion-PanTumor01 continúan demostrando una respuesta tumoral prometedora y así como el control de la enfermedad en pacientes que progresan tras el tratamiento estándar. El CMTN representa aproximadamente el 15% de los casos de cáncer de mama y se asocia con una mayor recurrencia de la enfermedad y peor pronóstico en comparación con otros subtipos de cáncer de mama. Se estima que solo el 12% de los pacientes con CMTN metastásico sobreviven cinco años después del diagnóstico y la mediana de SG es de entre 12 y 18 meses.
En CMM triple negativo el ensayo Tropion-PanTumor01 muestra una duración de la respuesta prometedora de este ADC como monoterapia en pacientes previamente tratados
En este ensayo se observó una tasa de respuesta objetiva (TRO) del 32% en una cohorte de 44 pacientes con CMTN metastásico, según BICR. Se observó un caso en RC, 13 RP y 18 casos de enfermedad estable (EE). La mediana de duración de la respuesta (DdR) fue de 16,8 meses después de una mediana de seguimiento de 19,3 meses. Se observó una TBC del 39% y una TCE del 80%. La mediana de SLP fue de 4,4 meses y la mediana de SG fue de 13,5 meses.
En cuanto al ensayo de fase 1b/2 Begonia, los resultados actualizados del brazo 7 del ensayo mostraron una actividad clínica prometedora de este ADC en combinación con durvalumab, un inhibidor de puntos de control inmunitario, en pacientes con CMTN no resecable, localmente avanzado o metastásico no tratados previamente. Se observó una TRO del 73,6% en 53 pacientes tratados con esta combinación de fármacos según lo evaluado por el investigador. Se observaron cuatro casos en RC y 35 RP. Las respuestas se observaron independientemente de la expresión de PD-L1 y fueron duraderas, con el 82% de los pacientes que continuaron respondiendo en el momento del corte de datos el 22 de julio de 2022.