Redacción
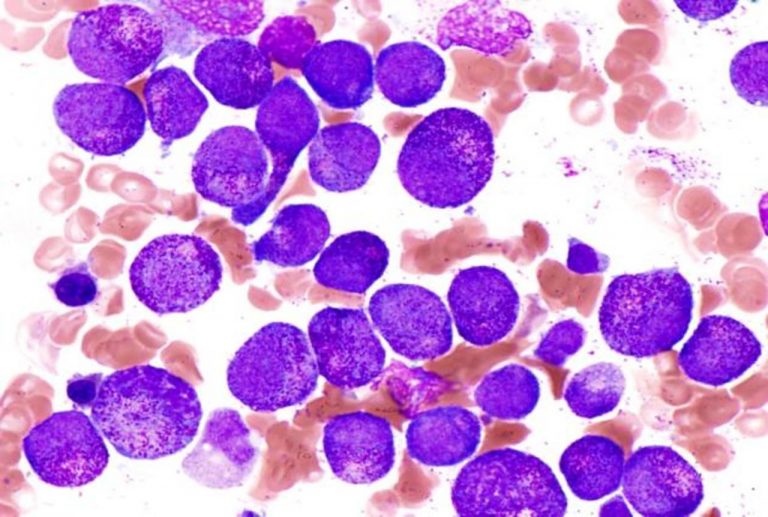
La terapia CAR-T axicabtagén ciloleucel (Yescarta), desarrollada por Kite, compañía de Gilead Sciences especializada en terapia celular, ha demostrado una mejora estadísticamente significativa en la supervivencia global (SG) en comparación con el SoC para el tratamiento inicial de pacientes adultos con linfoma B difuso de células grandes en recaída o refractario dentro de los 12 meses posteriores a la finalización de la terapia en primera línea. Así lo indican los resultados del análisis primario de SG del estudio de fase 3 ZUMA-7.
La SG se designó como objetivo secundario clave preespecificado clínicamente importante, definido como el tiempo transcurrido desde la aleatorización hasta la muerte por cualquier causa. Además, esta investigación se realizó bajo un protocolo especial de evaluación con la FDA (Food and Drug Administration). Por otro lado, se considera el primer y más grande estudio de fase 3 de una terapia CAR-T y con el seguimiento más largo, que ha demostrado una supervivencia libre de eventos (SLE), el objetivo principal, superior al SoC.
Los datos del ensayo ZUMA-7 respaldaron la aprobación de axicabtagén ciloleucel por parte de la Comisión Europea para el tratamiento de pacientes adultos con linfoma B difuso de células grandes
Asimismo, los datos del ensayo ZUMA-7 respaldaron la aprobación de axicabtagén ciloleucel por parte de la Comisión Europea en octubre de 2022 para el tratamiento de pacientes adultos con linfoma B difuso de células grandes y linfoma de células B de alto grado que recaen dentro de los 12 meses posteriores a la finalización de la quimioinmunoterapia de primera línea, o son refractarios a ella. La aprobación europea siguió a la aprobación de EE. UU. para el tratamiento inicial de LBDCG R/R en abril de 2022. Tras ella, se obtuvo la autorización de la CAR-T de Gilead en otros países como Gran Bretaña, Israel, Japón y Suiza.
El SoC es un proceso de varios pasos que contempla un régimen de quimioinmunoterapia de rescate combinado basado en platino seguido de terapia de dosis alta y trasplante autólogo de progenitores hematopoyéticos (TAPH) en aquellos pacientes que responden a la quimioterapia de rescate. Unos hallazgos que serán presentados en su totalidad a finales de este año en el marco de una reunión científica.