Gema Maldonado
El alivio se podía leer este jueves en el rostro del Dr. Juan Carlos López Gutiérrez, que lleva más de 30 años extirpando neurofibromas plexiformes a niños y adolescentes en el Hospital Universitario La Paz de Madrid, donde dirige el Servicio de Cirugía Pediátrica. Reconoce que esa experiencia “ha sido dura” por la complejidad de este tipo de tumores, que crecen en las vainas de los nervios, lo que dificulta su abordaje y genera “miedo a las secuelas que puedan quedar”.
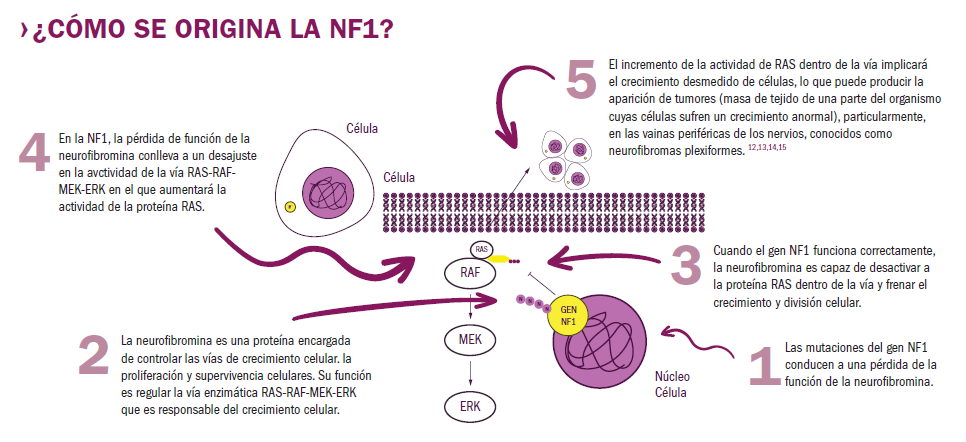
Desde el pasado uno de junio un fármaco aprobado por el Ministerio de Sanidad para su financiación viene a dar respuesta y aliviar el “terror” que pueden llegar a ser los neurofibromas plexiformes, cuyo desarrollo los provoca la neurofibromatosis tipo 1 (NF1), una enfermedad genética en la que se ve afectado el gen NF1, de forma que los pacientes que la sufren carecen de neurofibromina, la proteína que frena a las células en su crecimiento.
Dr. López Gutiérrez: “Selumetinib reduce el tamaño de los tumores y nos hace la cirugía más accesible y, en los casos en los que no son resecables completamente, podemos controlar el tumor con el fármaco”
Selumetinib, desarrollado por la compañía Alexion, es un inhibidor de la quinasa que bloquea la vía de señalización que permite a los neurofibromas plexiformes crecer. Ya está disponible para pacientes pediátricos de entre tres y 18 años con NF1 que presenten este tipo de tumores y que sean inoperables. “Ahora tenemos algo que nos ayuda”, explica el Dr. López Gutiérrez, “el fármaco reduce el tamaño de los tumores y nos hace la cirugía más accesible y, en los casos en los que no son resecables completamente por las secuelas que puede dejar, tenemos la posibilidad de tratar al paciente con el fármaco para controlar el tumor”.
Este medicamento, de administración oral dos veces al día y comercializado con el nombre de Koselugo, llega a España dos años después de que la Agencia Europea del Medicamento le diera su visto bueno. Previamente, ya le había otorgado la designación de medicamento huérfano, ya que se dirige a una patología considerada poco frecuente. Su aprobación se basa en el estudio de fase II Sprint Stratum 1, que demostró que selumetinib reducía el tamaño de tumores inoperables en niños, disminuía también el dolor que les provocaba y mejoraba su calidad de vida. De los 50 pacientes pediátricos incluidos en el estudio, 34 respondieron al tratamiento (68%) con una reducción del volumen de los tumores de, al menos, el 20%.
Este medicamento, de administración oral dos veces al día, llega a España dos años después de que la Agencia Europea del Medicamento le diera su visto bueno
“En la mayoría de los pacientes se frenaba el crecimiento del tumor y en la mitad, se reducía. Es decir, la mitad de estos niños pueden evitarse cirugías agresivas que pueden tener secuelas, se quitan el dolor y pueden tener mejor calidad de vida”, ha explicado el Dr. Álvaro Lassaletta, neurooncólogo pediátrico del Hospital Universitario Niño Jesús de Madrid.
Todo ello con un perfil de seguridad aceptable. Cinco pacientes interrumpieron el tratamiento por efectos adversos posiblemente relacionados con el fármaco. “Los efectos adversos no fueron graves, fundamentalmente son dermatológicos y gastrointestinales”, ha señalado este jueves Carlos Macedo, director médico de Alexion para España y Portugal. La aprobación de este medicamento, “es un hito por las dificultades que hay para tratar estos tumores, el 80% se quedan sin operar por el riesgo que supone la intervención”, ha añadido Macedo.
Carlos Macedo: “La aprobación de selumetinib es un hito por las dificultades que hay para tratar estos tumores, el 80% se quedan sin operar por el riesgo que supone la intervención”
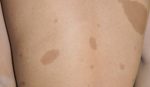
Pero esta enfermedad genética, que afecta a uno de cada 3.000 niños nacidos vivos, aún presenta muchos retos para médicos y pacientes. Su diagnóstico suele llegar a edades tempranas gracias a la presencia de manchas color café con leche en la piel, que son en muchos casos la señal de alarma. “Suele ser el primer signo para el diagnóstico, pero hay otras manifestaciones como lesiones características en los ojos, tumores benignos y los neurofibromas plexiformes. También pueden tener tumores cerebrales y hasta un 30% de estos pacientes tienen tumores en las vías ópticas y pueden llegar a perder la visión”, ha explicado el Dr. Lassaletta. Aunque sean tumores benignos, su crecimiento causa dolor, pueden afectar a la movilidad y provoca desfiguración, lo que afecta a la calidad de vida del paciente y genera estigma social. Un porcentaje bajo de estos tumores pueden llegar a malignizar y, cuando lo hacen, “tienen un mal pronóstico”.
La enfermedad es muy heterogénea y presenta una alta variabilidad. “Hay pacientes que no tienen apenas afectación a lo largo de su vida y otros que tienen gran afectación funcional o deterioro cognitivo”, señala el neurooncólogo del Niño Jesús. Y su progresión suele ser lenta o agresiva. “He visto pacientes que en un año han pasado de tener manchas de color café con leche a presentar neurofibromas plexiformes”, ha recordado el Dr. López Gutiérrez, quien ha lamentado la falta de un registro de pacientes con esta y otras enfermedades raras en España.
Hay ensayos en marcha con pacientes adultos y un estudio para administrar selumetinib en niños menores de tres años
Por el momento, este fármaco es un paso para mejorar la vida de los niños con NF1 y neurofibromas plexiformes. Alexion desarrolla ahora un ensayo que evalúa el fármaco en adultos, y trabaja en un estudio para formularlo en gránulos, con el fin de poder administrarlo a niños menores de tres años que no pueden tragar el tratamiento en pastillas. Además, “se ha visto efectividad de selumetinib en tumores cerebrales, puede que en un futuro llegue a tener esa indicación”, ha apuntado el Dr. Lassaletta.