..Redacción.
La Comisión Europea (CE) ha aprobado la comercialización de bimekizumab (Bimzelx) para el tratamiento de la psoriasis en placas de moderada a grave en adultos candidatos a recibir un tratamiento sistémico.
La CE aprueba bimekizumab para el tratamiento de la psoriasis en placas moderada a grave
Bimekizumab es un nuevo anticuerpo monoclonal humanizado IgG1 diseñado específicamente para inhibir de forma selectiva y dual tanto la IL-17A como la IL-17F, dos citocinas clave en los procesos inflamatorios. Se trata del primer tratamiento autorizado en la Unión Europea para la psoriasis en placas de moderada a grave con este mecanismo de acción selectivo.
La dosis aprobada y recomendada de bimekizumab es de 320 miligramos, administrada por vía subcutánea cada cuatro semanas, hasta la semana 16. A partir de ahí, la indicación sería de una dosis cada ocho semanas. La autorización de la CE se produce tras la opinión positiva emitida por el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) en junio de este año.
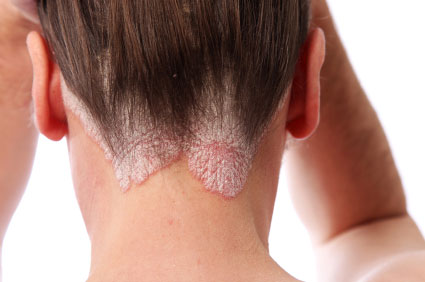
La psoriasis es una enfermedad crónica que puede tener un impacto físico y psicológico considerable en los pacientes
La autorización está respaldada por los resultados positivos de tres estudios fase III, que evaluaron la eficacia y seguridad del bimekizumab en 1.480 pacientes con psoriasis en placas de moderada a grave. Los resultados completos de los estudios fase III ‘BE READY’ y ‘BE VIVID’ han sido publicados en ‘The Lancet’. Por otro lado, los resultados del estudio fase III ‘BE SURE’ en ‘The New England Journal of Medicine’.
“La decisión de la CE para ‘Bimzelx’ en Europa supone la primera autorización de comercialización de este nuevo tratamiento para la psoriasis en todo el mundo. Esto representa un momento histórico tanto para la comunidad dermatológica como para UCB. Nuestra aspiración es poder mejorar la calidad de vida de las personas que viven con enfermedades graves. Por ello, estamos muy orgullosos de poder ofrecer una nueva opción terapéutica con grandes expectativas para las personas con psoriasis en placas de moderada a grave, en Europa”, ha subrayado el vicepresidente ejecutivo de Inmunología y responsable de UCB en Estados Unidos, Emmanuel Caeymaex.
La autorización supone la primera autorización de comercialización de este nuevo tratamiento para la psoriasis en todo el mundo
La psoriasis es una enfermedad crónica que puede tener un impacto físico y psicológico considerable en los pacientes. Además de repercutir en su calidad de vida. De hecho, puede afectar a la vida laboral, el ocio, las relaciones, la actividad sexual, la vida familiar y la vida social.
Una encuesta realizada a pacientes con psoriasis en placas mostró que al menos el 90% valora mucho el poder contar con un tratamiento que proporcione una remisión de las lesiones cutáneas. Así como, una respuesta mantenida y un inicio de acción rápido. Otro estudio demostró que alcanzar una remisión completa de las lesiones cutáneas puede marcar una diferencia significativa en el impacto que tiene la psoriasis en la calidad de vida de los pacientes en relación a su salud.
El 90% de los pacientes con psoriasis en placas valora mucho poder contar con un tratamiento que proporcione una remisión de las lesiones cutáneas
“En los estudios fase III, los pacientes tratados con bimekizumab alcanzaron niveles superiores de aclaramiento completo de las lesiones cutáneas en comparación con los tratados con placebo, adalimumab y ustekinumab. En el estudio fase IIIb, el tratamiento con bimekizumab consiguió mayores niveles de aclaramiento completo de las lesiones cutáneas que secukinumab. Así, en todos los estudios, alrededor del 60% de los pacientes tratados con bimekizumab alcanzaron un aclaramiento completo de las lesiones cutáneas en la semana 16, y esta respuesta se mantuvo durante al menos un año”, tal como ha explicado el profesor Richard Warren, de la Fundación Salford Royal NHS y la Universidad de Manchester, en Reino Unido.
Esta autorización es válida en los 27 estados miembros de la Unión Europea, así como en Islandia, Liechtenstein y Noruega. Así, en la actualidad, bimekizumab está siendo revisado por la Agencia Estadounidense del Medicamento (FDA). También se están llevando a cabo las revisiones reglamentarias en Australia, Canadá, Gran Bretaña y Japón.
Noticias complementarias:
- Tildrakizumab muestra una eficacia sostenida en el tratamiento de la psoriasis
- Almirall y Happify Health acuerdan desarrollar soluciones terapéuticas digitales con evidencia científica para pacientes de psoriasis
- Las vacunas contra el Covid-19 recomendadas para pacientes con psoriasis son las de ARN mensajero, según los dermatólogos