..Redacción.
La Administración de Alimentos y Medicamentos (FDA) ha otorgado una revisión prioritaria a la solicitud de autorización de producto biológico (sBLA) de trastuzumab deruxtecán, realizada por Daiichi Sankyo y AstraZeneca, para el tratamiento en EE.UU. de pacientes adultos con cáncer de mama HER2 positivo irresecable o metastásico que han recibido un régimen previo anti-HER2. Se trata de un anticuerpo conjugado (ADC) dirigido a HER2 desarrollado conjuntamente ambas compañías.
Según la fecha marcada por la ley de tarifas para usuarios de medicamentos recetados (Pdufa), el plazo de la FDA para su decisión regulatoria será durante el segundo trimestre de 2022. Mientras, la sBLA se está revisando en el marco del programa de Revisión Oncológica en Tiempo Real (RTOR) y del Proyecto Orbis. Estas dos iniciativas de la FDA están diseñadas para poner lo antes posible a disposición de los pacientes tratamientos eficaces contra el cáncer. De hecho, el programa RTOR permite a la FDA revisar los elementos de una solicitud antes de presentar la solicitud completa. Mientras que, el Proyecto Orbis, ofrece un marco para la presentación y revisión simultánea de medicamentos oncológicos entre los socios internacionales participantes.
 Susan Galbraith (AstraZeneca): “Esta revisión refleja el potencial transformador de esta innovación basado en el beneficio de supervivencia libre de progresión en este entorno”
Susan Galbraith (AstraZeneca): “Esta revisión refleja el potencial transformador de esta innovación basado en el beneficio de supervivencia libre de progresión en este entorno”
Aproximadamente uno de cada cinco casos de cáncer de mama es HER2 positivo. A pesar del tratamiento inicial con trastuzumab taxanos, las pacientes con cáncer de mama metastásico HER2 positivo a menudo experimentarán progresión de la enfermedad. De ahí la necesidad de contar con más opciones de tratamiento para retrasar aún más la progresión y aumentar la supervivencia.
Susan Galbraith, vicepresidenta ejecutiva, I+D Oncología de AstraZeneca, explica que, “esta revisión global y la Revisión Prioritaria en EE.UU. como parte del Proyecto Orbis es muy importante. Refleja el potencial transformador de esta innovación basado en el beneficio de supervivencia libre de progresión en este entorno. Esta noticia refuerza la importancia de llevar esta nueva opción a los pacientes lo antes posible”. Por su parte, el director global de I+D de Daiichi Sankyo, Ken Takeshita, señala que “la priorización de nuestra solicitud por parte de la FDA remarca el potencial de este medicamento; y la necesidad continua de agilizar la disponibilidad de nuevas opciones de tratamiento”.
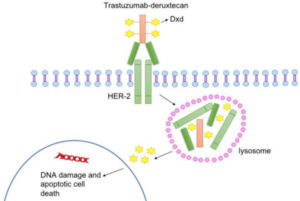 Trastuzumab deruxtecán demostró una reducción del 72% en el riesgo de progresión de la enfermedad o muerte en comparación con T-DM1
Trastuzumab deruxtecán demostró una reducción del 72% en el riesgo de progresión de la enfermedad o muerte en comparación con T-DM1
Reducción del riesgo de progresión
La sBLA se basa en datos del ensayo Destiny-Breast03 presentados durante el Congreso de la Sociedad Europea de Oncología Médica (ESMO 2021). En este, trastuzumab deruxtecán demostró una reducción del 72% en el riesgo de progresión de la enfermedad o muerte en comparación con T-DM1, en pacientes con cáncer de mama HER2 positivo irresecable y/o metastásico tratado previamente con trastuzumab y taxanos.
Por otro lado, el ensayo registró que un 94,1% de los pacientes tratados con este medicamento estaban vivos al año, en comparación con el 85,9% de los pacientes tratados con T-DM1. Además, la tasa de respuesta objetiva (ORR) confirmada se duplicó en el brazo de la terapia de Daiichy Sankyo y AstraZeneca frente al de T-DM1 (79,7% frente a 34,2%).
Noticias complementarias
- Resultados positivos del ensayo de fase III con trastuzumab deruxtecán en cáncer de mama metastásico con baja expresión de HER2
- Trastuzumab deruxtecán reduce en un 72% el riesgo de progresión o muerte por cáncer de mama metastásico HER2 positivo
- Trastuzumab deruxtecan muestra resultados positivos en tres tumores con alteraciones en HER2
- Dr. Javier Cortés: «El tratamiento con T-DXd en cáncer de mama metastásico HER2+ muestra una impresionante mejora sin precedentes”