Cristina Cebrián/Juan Ramírez
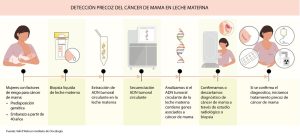
Alcanzar el diagnóstico precoz de cáncer de mama en el posparto a partir de muestras de leche materna es el objetivo que se ha propuesto un equipo de investigadores del Vall d’Hebron Instituto de Oncología (VHIO). Por el momento, ya han conseguido detectar mutaciones presentes en el tumor en la leche materna, incluso cuando el tumor es muy pequeño. “Ahora somos capaces de detectarlo mediante una muestra de leche materna. Esto no se había utilizado hasta ahora como diagnóstico”, comenta con iSanidad la Dra. Cristina Saura, jefa de la Unidad de Mama del Hospital Vall d’Hebron y del Grupo de Cáncer de Mama del VHIO y una de las investigadoras del estudio publicado en Cancer Discovery.
A partir de aquí, conseguir financiación es clave para el siguiente paso que se ha propuesto este equipo: incluir a 5.000 mujeres sanas embarazadas, con más de 40 años o que tengan alguna mutación genética que aumente su riesgo de padecer cáncer, para testar el panel genómico basado en NGS que han diseñado.
¿Cómo surgió la idea de comenzar esta investigación?
La investigación surgió a partir de una paciente que acudió a una consulta, ante la preocupación de haber podido transmitir el cáncer de mama a su segunda hija a través de la lactancia materna. A ella se le diagnosticó el cáncer de mama durante el embarazo de su tercera hija, pero había alargado mucho la lactancia y se había solapado en el tiempo. Nos aportó una muestra de leche materna que tenía en casa congelada desde hacía año y medio. Le explicamos a la paciente que no se ha demostrado nunca que el cáncer se pueda transmitir a partir de la leche materna. Si que encontramos mutaciones, que estaban presentes en el tumor, en la leche materna.
Cuando analizamos la sangre de estas mujeres incluidas en el estudio, las muestras eran negativas. Sin embargo, al utilizar la muestra alternativa de la leche materna, fuimos capaces de detectar tumores muy pequeños
A partir de ahí, comenzamos el proyecto para averiguar si este era un caso aislado o si era algo que se repetía. Efectivamente, observamos estas alteraciones en las 19 mujeres que incluimos en el estudio, con diagnóstico de cáncer de mama durante el embarazo o posparto.
¿Cuáles son sus principales conclusiones?
Hemos sido capaces de detectar mutaciones presentes en el tumor en la leche materna, a pesar de que el tumor sea muy pequeño. En pacientes con metástasis, ya utilizábamos la biopsia líquida en sangre para detectar las mutaciones del tumor. Lo novedoso de este estudio preliminar es que ahora somos capaces de detectarlo mediante una muestra de leche materna, que no se había utilizado hasta ahora como diagnóstico.
 Cuando analizamos la sangre de estas mujeres incluidas en el estudio, las muestras eran negativas. Sin embargo, al utilizar la muestra alternativa de la leche, fuimos capaces de detectar tumores muy pequeños. El siguiente paso que vamos a dar es comprobar si este test que hemos diseñado podría utilizarse para hacer el diagnóstico precoz de cáncer de mama.
Cuando analizamos la sangre de estas mujeres incluidas en el estudio, las muestras eran negativas. Sin embargo, al utilizar la muestra alternativa de la leche, fuimos capaces de detectar tumores muy pequeños. El siguiente paso que vamos a dar es comprobar si este test que hemos diseñado podría utilizarse para hacer el diagnóstico precoz de cáncer de mama.
Es llamativo el hecho de que la leche materna se haya convertido en una muestra mejor que la sangre para detectar estos tumores, ¿a qué se debe?
Es una cuestión de cantidad. En pacientes con metástasis, la cantidad de ADN que circula en sangre es suficiente para que una biopsia líquida en sangre lo detecte. Lo que ocurre es que, en mujeres que tienen un tumor muy pequeño y localizado solo en la mama, la cantidad de ADN que se libera en sangre es tan pequeña que con las técnicas actuales no somos capaces de detectarlo.
En mujeres que tienen un tumor muy pequeño y localizado solo en la mama, la cantidad de ADN que se libera en sangre es tan pequeña que con las técnicas actuales no somos capaces de detectarlo
Lo que hemos visto en este estudio es que, en 13 de las 15 mujeres a las que analizamos la leche, observamos que esta era positiva. En cuanto a las dos mujeres que tenían la leche negativa, eran mujeres a las que habíamos recogido la muestra menos de cinco días después del parto, porque tenían que seguir con su tratamiento de quimioterapia. Por tanto, cuando ha habido tiempo suficiente para que se produzca la leche y esta “arrastre” el ADN que pueda estar presente en el tumor, vemos que la cantidad de leche es tan alta que, aunque el tumor sea pequeño, somos capaces de detectarlo muy pronto.
¿Supone un cambio significativo para la detección precoz del cáncer de mama en mujeres que han dado a luz recientemente?
Este hallazgo es muy bonito, pero a nivel práctico, lo que hacíamos era analizar primero el tumor y, después, buscar esas mutaciones en la leche. Lo que realmente nos motiva es intentar buscarle una utilidad para el diagnóstico precoz. Para ello, había que dar un paso más: diagnosticar a mujeres sin saber qué mutaciones van a tener. Lo que hemos hecho es diseñar un panel genómico basado en NGS que incluye las 54 mutaciones más frecuentes que aparecen en mujeres diagnosticadas de cáncer de mama con menos de 45 años. Ese panel ya lo hemos aplicado a estas mujeres y hemos observado que en el 71% de los casos detecta la leche positiva.
Los resultados que presentamos son muy ilusionantes, aunque a día de hoy no sabemos si esto lo podemos utilizar para el diagnóstico precoz. El siguiente paso es diseñar un estudio en el que vamos a incluir a 5.000 mujeres sanas embarazadas, con más de 40 años o que tengan alguna mutación genética que aumente su riesgo de padecer cáncer, para testar nuestro panel genómico.
¿Es la primera vez que se realiza un estudio de estas características?
Si, es la primera vez. Ya se habían hecho estudios que habían estudiado proteínas en sangre y habían descrito características biológicas de la leche. Es la primera vez que se detectan mutaciones en pacientes con cáncer y que se le busca una utilidad práctica al hallazgo. Nosotros en el VHIO hacemos investigación traslacional. Es decir, una investigación que nos sirva para aplicar los resultados a la práctica clínica.
Los resultados que presentamos son muy ilusionantes, aunque a día de hoy no sabemos si esto lo podemos utilizar para el diagnóstico precoz
¿Sería factible, en nuestro sistema sanitario, realizar este cribado a todas las mujeres tras el parto?
Todos los sistemas de cribado tienen en cuenta la sensibilidad de la prueba, así como la especificidad (cuántas veces se equivoca un test) y el coste que supone realizar esas pruebas. Por tanto, lo ideal sería implantar una prueba muy sensible, específica y con un precio competitivo. En este sentido, nuestro panel genómico puede tener un coste razonable para el sistema sanitario.
 Cuanto antes detectemos el cáncer de mama, más posibilidades habrá de curarlo. Los costes derivados de una mayor curación de mujeres son muy elevados. Es un camino que nos queda por recorrer. Tenemos que ver realmente cómo de bueno es el test al detectar a pacientes enfermas, si se equivoca o no y qué costes supondría. Igual que se hace la prueba del talón a niños recién nacidos para descartar metabolopatías importantes, en un futuro quizá podríamos recoger muestras de leche durante el posparto para descartar un cáncer de mama.
Cuanto antes detectemos el cáncer de mama, más posibilidades habrá de curarlo. Los costes derivados de una mayor curación de mujeres son muy elevados. Es un camino que nos queda por recorrer. Tenemos que ver realmente cómo de bueno es el test al detectar a pacientes enfermas, si se equivoca o no y qué costes supondría. Igual que se hace la prueba del talón a niños recién nacidos para descartar metabolopatías importantes, en un futuro quizá podríamos recoger muestras de leche durante el posparto para descartar un cáncer de mama.
¿Es muy frecuente el cáncer de mama en el posparto? ¿Qué peculiaridades presenta en la paciente?
Afortunadamente es poco frecuente. Lo que ocurre es que la nueva definición de cáncer de mama en el posparto incluye a mujeres diagnosticadas hasta diez años después del parto. En cualquier caso, las estadísticas nos dicen que hasta el 55% de las mujeres diagnosticadas de cáncer de mama a una edad joven estarían en esta franja de hasta diez años posparto.
Igual que se hace la prueba del talón a niños recién nacidos para descartar metabolopatías importantes, en un futuro quizá podríamos recoger muestras de leche durante el posparto para descartar un cáncer de mama
Aunque no es frecuente tener cáncer de mama a una edad joven, muchas mujeres han tenido hijos en los últimos diez años. Esto no aplicaría a toda la población, pero si a mujeres que han sido madres y que decidieron hacer lactancia materna. Es una población muy sensible. Por todo ello, en el estudio que vamos a iniciar, vamos a reclutar a mujeres mayores de 40 años.
Los tumores que se diagnostican durante el embarazo suelen tener las mismas características que la población general. Sin embargo, lo que estamos viendo, es que en el embarazo y posparto se diagnostica el tumor en estadios más avanzados. Los cambios fisiológicos que ha sufrido la mama para prepararse para la lactancia hacen que un tumor no se detecte hasta que es más grande. Con lo cual, los tumores del posparto tienen un peor pronóstico porque suelen diagnosticarse en estados más avanzados que en la población general.
Este domingo se celebró el Día Mundial de la Investigación Contra el Cáncer. Como investigadora, ¿qué necesidades deberían cubrirse para facilitar esta labor científica?
Nos guste o no, la financiación es clave para avanzar y sacar adelante los proyectos. Los científicos podemos tener mejores o peores ideas, pero al final, cualquier proyecto por muy grande que sea, empieza con una idea.
Nosotros calculamos que ahora necesitamos unos 15 millones de euros para realizar este siguiente estudio. Este es el punto en el que nos encontramos ahora y no es fácil
Nosotros empezamos este trabajo financiando los primeros experimentos mediante la donación de la asociación El paseíco de la mama. Esta la creó una familia con una mujer diagnosticada en nuestro hospital durante su primer embarazo. Desde hace más de una década, cada año la familia organiza una iniciativa solidaria y donan el dinero recaudado a la investigación. En general, las pacientes están muy motivadas y empoderadas en esta lucha contra el cáncer. Con los primeros resultados que obtuvimos gracias a esta financiación altruista, ya pudimos aplicar a becas y conseguimos las del Instituto de Salud Carlos III, la Asociación Española contra el Cáncer, la Sociedad Española de Oncología Médica, Fundación La Caixa y Fundación FERO.
Hay dos puntos clave. Primero, conseguir financiación sin tener datos y, después, cuando ya tienes datos prometedores, se necesita mucho dinero. En este sentido, el mecenazgo también ayuda mucho. Nosotros calculamos que ahora necesitamos unos 15 millones de euros para realizar este siguiente estudio. Este es el punto en el que nos encontramos ahora y no es fácil.













