..C.C.
La Agencia Europea del Medicamento (EMA) ha comenzado a evaluar una solicitud de autorización de comercialización condicional para el fármaco antiviral de Pfizer, Paxlovid, contra el Covid-19. En concreto, se trata de la indicación para el tratamiento de Covid-19 de leve a moderado en pacientes adultos y adolescentes a partir de 12 años de edad y con un peso mínimo de 40 kg, que presentan un alto riesgo de progresión a enfermedad grave.
De esta forma, la EMA analizará los riesgos y beneficios del antiviral de Pfizer en un plazo corto de tiempo. De hecho, el organismo señala que podría tener su opinión en cuestión de semanas. Esto dependerá de si los datos presentados son “suficientemente sólidos” y de si se necesita más información para respaldar la evaluación. En caso de que se apruebe su comercialización en Europa, el antiviral serviría para reducir la necesidad de hospitalización de pacientes con Covid-19. Y, por tanto, ayudaría a aliviar la sobrecarga asistencial que atraviesan los sistemas de salud.
 La EMA analizará los riesgos y beneficios del antiviral de Pfizer en un plazo corto de tiempo
La EMA analizará los riesgos y beneficios del antiviral de Pfizer en un plazo corto de tiempo
Este proceso acelerado puede realizarse gracias a que el Comité de Medicamentos de Uso Humano (CHMP) de la EMA ya había iniciado una revisión continua de los datos sobre el medicamento. En ella se incluyeron datos de estudios de laboratorio, animales y clínicos, así como datos sobre la calidad del fármaco. Asimismo, el CHMP analizó los resultados provisionales del principal estudio sobre este antiviral en pacientes no hospitalizados y que no recibieron la vacuna contra el Covid-19. Además, estos pacientes presentaban síntomas y, al menos, una afección subyacente que los ponía en riesgo de padecer una enfermedad grave.
Evaluación del antiviral en niños
En paralelo, el Comité de Seguridad de la EMA (PRAC), comenzó la evaluación del plan de gestión de riesgos que propuso Pfizer. En el se describen las medidas para identificar, caracterizar y minimizar los riesgos del medicamento. Además, según los plazos acelerados para los productos relacionados con el Covid-19, el Comité de Medicamentos para Niños de la EMA aportó su opinión sobre el plan de investigación pediátrica de Pfizer, que describe cómo debe desarrollarse y estudiarse el medicamento para su uso en niños.
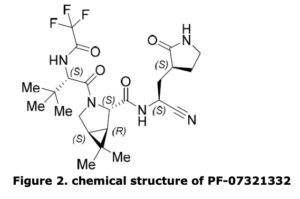
Este antiviral oral reduce la capacidad del SARS-CoV-2 para multiplicarse en el organismo y bloquea la actividad de una enzima para que el virus se multiplique
Este antiviral oral reduce la capacidad del SARS-CoV-2 para multiplicarse en el organismo. Gracias a su principio activo, PF-07321332, Paxlovid bloquea la actividad de una enzima necesaria para que el virus se multiplique. Además, el fármaco de Pfizer contiene una dosis baja de ritonavir que ralentiza la descomposición del PF-07321332. Así, puede permanecer más tiempo en el organismo a niveles que afectan al virus.