..P.M.S.
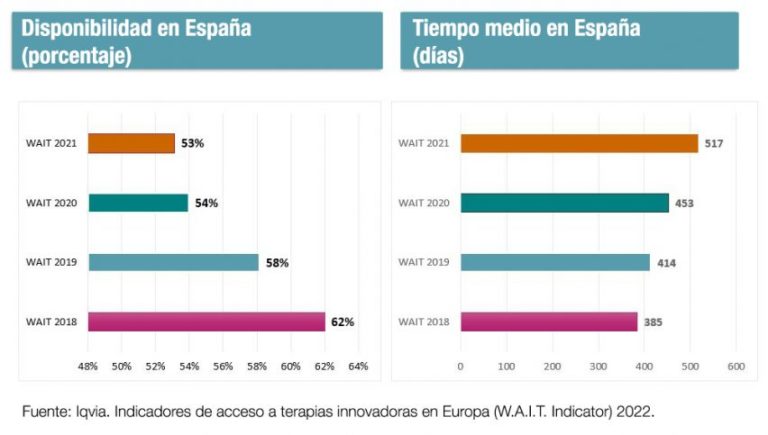
El tiempo medio que transcurre desde que un nuevo medicamento es aprobado por las autoridades europeas hasta que está disponible para su uso en España a finales de 2021 es de 517 días, más de 17 meses de retraso. Esta cifra sigue aumentando ya que al finalizar el año 2020 era de 453 días. Así lo pone de manifiesto el informe anual Indicadores de acceso a terapias innovadoras en Europa (W.A.I.T. Indicator), elaborado por la consultora Iqvia para la Federación Europea de Asociaciones de la Industria Farmacéutica (Efpia), que analiza las autorizaciones entre 2017 y 2020.
El tiempo de aprobación de los nuevos medicamentos en España sigue siendo superior al de los países de referencia en Europa. Así, en Alemania la espera es de 133 días; en Francia, de 240 días; en Inglaterra, de 340, y en Italia, de 429. “El problema del acceso de los pacientes españoles a los nuevos medicamentos se agrava: si bien nos situamos algo por encima de la media de 40 países europeos, nuestro sistema público de salud dispone de menos nuevos fármacos que los países de referencia en Europa y los incorpora más tarde», lamentan desde Farmaindustria.
Según el informe, en España solo están disponibles el 53% de los fármacos autorizados en Europa en los últimos cuatro años, frente al 92% en Alemania, el 77% de Italia, el 68% de Inglaterra y el 66% de Francia
Otro de los indicadores que mide el estudio es la disponibilidad. Es decir, el número de nuevos medicamentos que son incluidos en la financiación pública y puestos a disposición de los pacientes. “El porcentaje de fármacos disponibles en España es también el más bajo de los grandes mercados europeos“, afirma Farmaindustria. A fecha 1 de enero de 2022, solo estaban disponibles en España 85 de los 160 fármacos aprobados (53%) en Europa en los últimos cuatro años. En Alemania Este porcentaje es del 92% en Alemania, del 79% Italia, del 68% Inglaterra, y del 66% en Francia. Desde el año 2018, el porcentaje de disponibilidad en España ha disminuido en nueve puntos porcentuales.
Este documento muestra que España también tiene el mayor porcentaje de disponibilidad restringida, con un 41%. Así, del 53% de los medicamentos disponibles sobre el total de autorizados en Europa, cuatro de cada diez lo están en nuestro país con algún tipo de restricción en su uso. Ese porcentaje es del 1% en Alemania, del 13% en Italia, del 15% en Francia y del 39% en Inglaterra.
Del 53% de los medicamentos disponibles sobre el total de autorizados en Europa, cuatro de cada diez lo están en nuestro país con algún tipo de restricción en su uso
Medicamentos oncológicos y huérfanos
El informe refleja que el tiempo medio en 2021 para acceder a los nuevos medicamentos oncológicos en España ha aumentado en 74 días respecto a 2018. De esta forma, la demora alcanza los 469 días. Respecto a la disponibilidad de los tratamientos oncológicos aprobados en Europa entre 2017 y 2020, España presenta la cifra más baja de los países de nuestro entorno. En España están disponibles el 61% (25 de los 41 fármacos oncológicos aprobados en este tiempo), mientras que lo están el 100% en Alemania, el 90% en Italia, el 85% en Inglaterra y el 80% en Francia 80%.
En cuanto a los medicamentos huérfanos, el tiempo medio en 2021 para el acceso en España ha aumentado en 184 días respecto al informe de 2018. De esta forma, se sitúa en los 696 días, casi dos años de retraso. Además, sólo el 44% (25 de 57) de estos tratamientos autorizados en Europa en los últimos cuatro años están disponibles en España. Es el porcentaje más bajo de los países de referencia: Alemania tiene el 95%; Italia, el 75%; Francia, el 72%, e Inglaterra, el 61%.
La patronal farmacéutica viene proponiendo una serie de mejoras en el procedimiento actual de evaluación y fijación de precios y financiación pública de medicamentos en nuestro país. Su objetivo es establecer un modelo que sea “ágil, predecible y eficiente», de manera que ayude a solucionar con urgencia el problema actual. “Como muestran estos datos, tenemos un problema estructural en el procedimiento de evaluación y financiación, que no es tan ágil como el de los países con los que debemos compararnos», explica Humberto Arnés, director general de Farmaindustria.
Humberto Arnés (Farmaindustria): “España debe aspirar a estar entre los países que mejor acceso proporcionan a los nuevos tratamientos”
Noticias complementarias
- Farmacéuticos e industria presentan la Guía de Excelencia para realización de ensayos clínicos en Farmacia Hospitalaria
- ¿Qué puede ofrecer el big data y los datos en vida real a la evaluación de nuevos medicamentos?
- Dr. Rodríguez Lescure: «Estamos hablando de incorporar bioinformáticos y no podemos contratar médicos»
- Javier Urzay (Farmaindustria): «Tenemos la oportunidad de convertir a España en una potencia en investigación farmacéutica»
- López-Belmonte: «España ha sido el primer país de Europa y el cuarto del mundo en ensayos de tratamientos para Covid-19»